
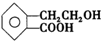
 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.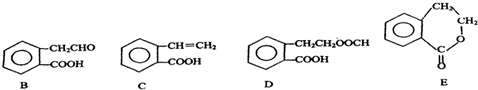
 .
. +2NaOH→
+2NaOH→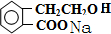 +HCOONa+H2O.
+HCOONa+H2O. .
. 分析 (1)A发生消去反应生成C;
(2)分子式相同结构不同的有机物互称同分异构体;
(3)HCHO分子中所有原子都在同一平面内,苯、乙烯、乙炔分子中所有原子共平面,据此判断;
(4)C中含有碳碳双键,能发生加聚反应生成高分子化合物;
(5)D与NaOH溶液共热发生分解反应;
(6)A发生催化氧化反应生成B.
解答 解:(1)根据结构简式知,A发生消去反应生成C,故答案为:消去反应;
(2)在A~E五种物质中,互为同分异构体的是C与E,故答案为:CE;
(3)HCHO分子中所有原子都在同一平面内,苯、乙烯、乙炔分子中所有原子共平面,据此知,所有原子在同一平面内的是C,故答案为:C;
(4)C中含有碳碳双键,能发生加聚反应生成高分子化合物,该高分子化合物结构简式为 ,故答案为:
,故答案为: ;
;
(5)D的水解产物中苯甲酸结构及生成的HCOOH均与NaOH反应,则D与NaOH溶液共热反应的化学方程式为 +2NaOH→
+2NaOH→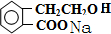 +HCOONa+H2O,
+HCOONa+H2O,
故答案为: +2NaOH→
+2NaOH→ +HCOONa+H2O;
+HCOONa+H2O;
(6)A中含有-OH,可发生氧化反应生成-CHO,反应的方程式为 ,
,
故答案为: .
.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,注意反应前后官能团发生的变化,知道常见反应类型及反应条件.


科目:高中化学 来源: 题型:解答题
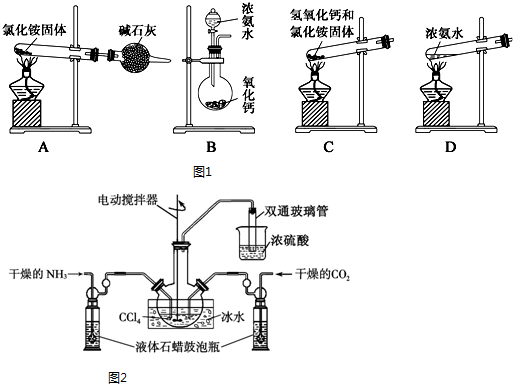
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr;写出B盛AgNO3溶液的试管中所发生反应的化学方程式:HBr+AgNO3=AgBr↓+HNO3.
+HBr;写出B盛AgNO3溶液的试管中所发生反应的化学方程式:HBr+AgNO3=AgBr↓+HNO3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下面给出了四种烃A、B、C、D的相关信息:
下面给出了四种烃A、B、C、D的相关信息: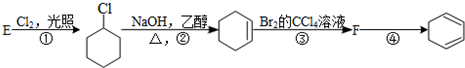
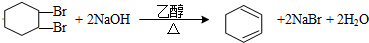 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极和负极必须是两种不同的金属 | |
| B. | 电子流入的一极为正极 | |
| C. | 原电池工作时,正极和负极上发生的都是氧化还原反应 | |
| D. | 原电池工作时,实现了将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
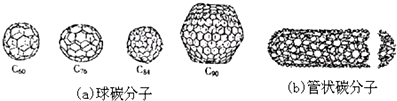
| A. | 金刚石和石墨的熔点肯定要比C60高 | |
| B. | 据估计C60熔点比金刚石和石墨要高 | |
| C. | 无论是球碳分子,还是管状碳分子、洋葱状碳分子,都应看作是碳的同素异形体 | |
| D. | C60的熔点低于C90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
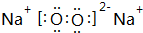 ,其中含有的化学键为离子键、共价键.
,其中含有的化学键为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N 2为0.2 mol•L-1,H 2为0.6 mol•L-1 | |
| B. | N 2为0.15 mol•L-1 | |
| C. | N 2、H 2均为0.18 mol•L-1 | |
| D. | NH 3为0.4 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com