
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
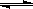 MnS2O6的△H______0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是______.
MnS2O6的△H______0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是______.

科目:高中化学 来源: 题型:阅读理解

| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
 MnS2O6的△H
MnS2O6的△H查看答案和解析>>
科目:高中化学 来源: 题型:
高纯碳酸锰广泛应用于电子工业,是制造高性能磁性材料的主要原料。新工艺采用工业冶铜后的废气SO2进行湿法浸取软锰矿(主要含MnO2,同时含有少量SiO2、Fe2O3、Al2O3)来制备。(已知亚硫酸酸性强于碳酸)
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后
过滤分离;
③调节滤液pH值为6.5~7.2 ,然后加入NH4HCO3,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰。
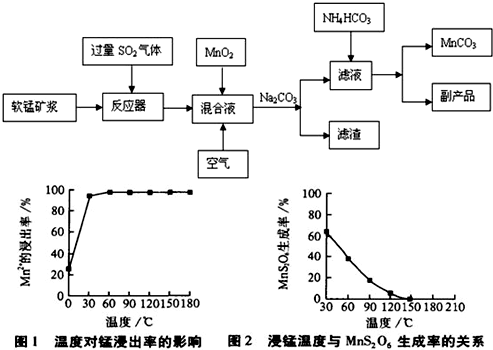
工业流程图如下:
已知生成氢氧化物的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
请根据题中有关信息回答问题:
(1)“浸锰”后所得混合液中主要存在的金属阳离子有 。
(2)由图可知,副反应MnSO4+SO2 MnS2O6的△H 0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是 。
(3)步骤②中加入MnO2和通入空气的作用 。
(4)③中控制温度为60~70℃,温度不宜太高的原因是 。
(5)与传统的电解法制MnCO3工艺相比较,新工艺的优点是 (写两点)。
查看答案和解析>>
科目:高中化学 来源:2011届江苏省淮阴中学高三上学期期末模拟化学试卷 题型:填空题
高纯碳酸锰广泛应用于电子工业,是制造高性能磁性材料的主要原料。新工艺采用工业冶铜后的废气SO2进行湿法浸取软锰矿(主要含MnO2,同时含有少量SiO2、Fe2O3、Al2O3)来制备。(已知亚硫酸酸性强于碳酸)
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后
过滤分离;
③调节滤液pH值为6.5~7.2 ,然后加入NH4HCO3 ,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰。
工业流程图如下: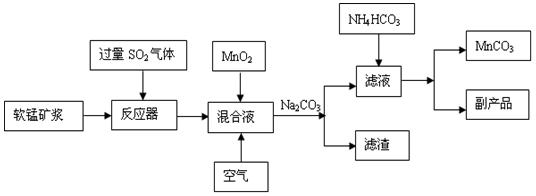

已知生成氢氧化物的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
 MnS2O6的△H 0(填>、<或=),为减少MnS2O6的生成,“浸锰”的适宜温度是 。
MnS2O6的△H 0(填>、<或=),为减少MnS2O6的生成,“浸锰”的适宜温度是 。查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省高三上学期期末模拟化学试卷 题型:填空题
高纯碳酸锰广泛应用于电子工业,是制造高性能磁性材料的主要原料。新工艺采用工业冶铜后的废气SO2进行湿法浸取软锰矿(主要含MnO2,同时含有少量SiO2、Fe2O3、Al2O3)来制备。(已知亚硫酸酸性强于碳酸)
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后
过滤分离;
③调节滤液pH值为6.5~7.2 ,然后加入NH4HCO3 ,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰。
工业流程图如下:


已知生成氢氧化物的pH如下表:
|
物质 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
8.3 |
|
完全沉淀pH |
3.7 |
9.6 |
9.8 |
请根据题中有关信息回答问题:
(1)“浸锰”后所得混合液中主要存在的金属阳离子有 。
(2)由图可知,副反应MnSO4+
SO2  MnS2O6的△H 0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是
。
MnS2O6的△H 0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是
。
(3)步骤②中加入MnO2和通入空气的作用 。
(4)③中控制温度为60~70℃,温度不宜太高的原因是 。
(5)与传统的电解法制MnCO3工艺相比较,新工艺的优点是 (写两点)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省淮安市淮阴中学高三(上)期末化学模拟试卷(解析版) 题型:解答题

| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
 MnS2O6的△H______0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是______.
MnS2O6的△H______0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是______.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com