
分析 (1)利用反应前后各物质的质量差,确定反应物和生成物,并根据质量守恒确定反应中物质间的质量比,根据相对分子质量以及物质的质量比,确定方程式的系数,来书写化学方程式.
(2)计算A的反应速率v=$\frac{△c}{△t}$,反应速率之比等于化学方程式计量数之比计算得到BC.
解答 解:(1)根据质量守恒定律,生成物D的质量=25g+5g+10g-10g-21g=9g,反应后A、B质量减小,所以A、B是反应物,C、D是生成物,四种物质在反应中的质量比=(25g-10):5g:(21g-10g):9g=15:5:11:9,A、B、C、D的相对分子质量分别为30、20、44、18,则四种物质的物质的量之比是:$\frac{15}{30}$$\frac{5}{20}$:$\frac{11}{44}$:$\frac{9}{18}$=2:1:1:2,所以方程式的系数是2A+B=C+2D,
故答案为:2A+B=C+2D;
(2)将25克A、5克B和10克C一起充入容积为1L的密闭容器中,加热发生反应,2min后混合物中含10克A,反应前后A的物质的量变化△n(A)=$\frac{25g-10g}{30g/mol}$=0.5mol,v(A)=$\frac{\frac{0.5mol}{1L}}{2min}$=0.25mol•L-1•min-1、v(B)=v(C)=$\frac{1}{2}$v(A)=0.125mol•L-1•min-1,
故答案为:0.25mol•L-1•min-1、0.125mol•L-1•min-1,0.125mol•L-1•min-1.
点评 本题考查学生质量守恒在化学计算中的应用,化学反应速率概念分析应用,注意方程式的系数之比和物质的量之比之间的相等关系,化学反应速率之比等于化学方程式计量数之比的计算,难度不大.


科目:高中化学 来源: 题型:解答题
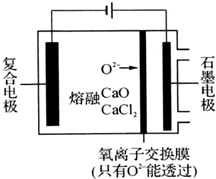 纳米二氧化钛作为一种新型的光催化剂,其用途相当广泛.金属钛具有优良的性能,是航天工业的重要材料.水解法制备纳米二氧化钛和电解钛的过程如下:
纳米二氧化钛作为一种新型的光催化剂,其用途相当广泛.金属钛具有优良的性能,是航天工业的重要材料.水解法制备纳米二氧化钛和电解钛的过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | C-F | H-F | F-F | H-H | H-N |
| 键 能 | 414 | 489 | 565 | 158 | 436 | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
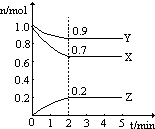
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
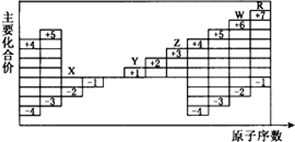
| A. | 五种元素中有三种属于非金属元素,且三种非金属元素均存在同素异形现象 | |
| B. | 五种元素中有两种属于金属元素,且两种金属元素均不能在空气中稳定存在 | |
| C. | 五种元素的单质在固态时分别属于三种不同的晶体类型 | |
| D. | Y、Z、W三种元素的最高价氧化物的水化物相互之间均能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2-丁醇发生消去反应产物有2 种 | B. | 卤代烃都能发生水解反应 | ||
| C. | 醇在Cu/△条件下都能氧化成醛 | D. | 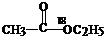 在酸性条件下水解产物是 在酸性条件下水解产物是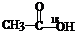 和C2H5OH 和C2H5OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com