
| 剩余固体的组成 | m的取值范围 | n的取值范围 |
| 只有铜 | ||
| 有铁和铜 | (用含m的代数式表示) |
分析 依据反应过程分析,最后溶液中加入硝酸银溶液生成氯化银沉淀,氯元素守恒可以直接计算原溶液A中氯化铁的浓度,氯化铁溶解铜生成氯化亚铁和氯化铜,加入铁粉发生的反应为①2Fe3++Fe=3Fe2+,②Fe+Cu2+=Fe2++Cu,引起质量变化的原因是反应①固体质量减小,反应②固体质量增加,结合质量变化和化学方程式列式计算.
解答 解:(1)从滤液C(忽略反应前后溶液体积的变化)中取出20.00mL,向其中滴入3.00mol•L-1 AgNO3溶液60.00mL时,溶液中的Cl-恰好完全沉淀,依据氯元素守恒20ml溶液中氯离子物质的量n(Cl-)=n(Ag+)=3.00mol/L×0.060L=0.18mol,所以原溶液800ml中含有氯离子物质的量为0.18mol×$\frac{800}{20}$=7.2mol,n(FeCl3)=$\frac{1}{3}$n(Cl-)=2.4mol,溶液A中FeCl3的物质的量浓度=$\frac{2.4mol}{0.8L}$=3.00mol/L,故答案为:3.00mol/L;
(2)铁粉加进去与铜离子反应,根据化合价升降守恒关系,原来三价铁离子转化为二甲铁离子化学价降低的数目等于铜单质转变为铜离子化学价升高数目,假设铁粉不再溶解,向溶液B中加入的铁粉化合价升高数目应该等于原来三价铁离子化合价降低数目,根据2Fe3++Fe=3Fe2+,化合价降低数目=n(FeCl3)×1=2.4,设加入铁的质量为xg,则根据化合价升降守恒知,2.4=$\frac{x}{56}×2$,x=67.2 g,故至少加入铁粉的质量为67.2g,故答案为:67.2g;
(3)当只有铜时,铁粉不能将铜置换,根据(2)计算知,当铁粉质量0<m≤67.2时成立;根据2FeCl3+Cu=2FeCl2+CuCl2,当三价铁完全反应时,消耗铜质量最大,为$\frac{64×2.4}{2}$=76.8g,故只有铜时0<n≤76.8;若有铁和铜,说明没有三价铁离子和二甲铜离子,铁粉可以过量,m>67.2,剩余铜的质量的最小值为(m-67.2)g,mg铁将铜离子全部置换出来,铜的质量为76.8g,反应了的铁的质量为67.2g,故固体质量=m+铜-反应的铁=m+76.8-67.2=m+9.6g,故(m-67.2)<n≤(m+9.6),故答案为:;
(4)加入铁粉发生的反应为①2Fe3++Fe=3Fe2+,②Fe+Cu2+=Fe2++Cu,引起质量变化的原因是反应①固体质量减小,反应②固体质量增加,设B溶液中亚铁离子物质的量为x,则溶解的铜物质的量为0.5x,
①2Fe3++Fe=3Fe2+,固体质量减少
2 56g
2.4mol-x 28(2.4-x)g
②Fe+Cu2+=Fe2++Cu,固体质量增加
1 ( 64-56)g
0.5x 0.5x(64-56)
则 28(2.4-x)g-0.5x(64-56)=100g-96.8g=3.2g
x=2mol
溶液B中c(FeCl2)=$\frac{2mol}{0.8L}$=2.5mol/L;
故答案为:2.50 mol•L-1.
点评 本题考查学生及氧化还原反应型离子方程式的书写方法及计算,利用化合价升降守恒,原子守恒等知识建立等式关系,分类讨论铜铁的用量与产物的关系,氧化还原反应过程中化学方程式的计算应用是本题难点,题目难度较大.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
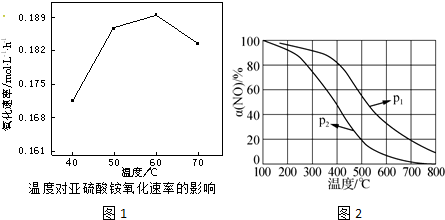
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
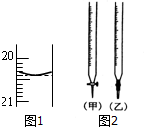 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.00 |
| 3 | 25.00 | 0.20 | 20.21 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向Ca(OH)2和NaOH的混合溶液中通入CO2 | |
| B. |  向FeCl3溶液中加入锌粉 | |
| C. |  向NaOH溶液中通入CO2 | |
| D. |  HCl与Cl2的混合通入NaOH溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
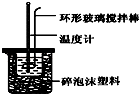 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:| 实验次数 | 起始温度t1/℃ | 起始温度t1/℃ | 终止温度t2/℃ |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键可以使离子相结合,也可以使原子相结合 | |
| B. | 非金属元素的原子之间只能形成共价键 | |
| C. | 化学反应过程中,反应物分子内的化学键断裂,产物分子中化学键形成 | |
| D. | 化学键是一种作用力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com