
| A、此时水的离子积KW=1×10-12 |
| B、水电离出的c(H+)=1×10-12mol.L-1), |
| C、水的电离程度随温度升高而增大 |
| D、c(Na+)=c(SO42-) |
| 10-12 |
| 0.01 |
| 10-12 |
| 0.01 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 温度℃ | 25 | 80 |
| 平衡常数 | 5×104 | 2 |
| A、上述反应的正反应为吸热反应 |
| B、25℃时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数也为5×104 |
| C、在80℃时,测得某时刻,Ni(CO)4、CO浓度均为1mol.L-1,则此时v(正)>v(逆) |
| D、达平衡后,在容器中再加入一定的Ni粉,则平衡会向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、任何一个化学反应都能达到一个化学平衡状态 |
| B、当可逆反应在一定条件下达到最大限度是,正反应速率和逆反应速率相等 |
| C、平衡状态是一种静止的状态 |
| D、化学反应的限度不可能通过改变外界条件而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在氧化还原反应中,一定是一种元素被氧化,另一种元素被还原 |
| B、在氧化还原反应中,不一定所有元素的化合价都发生改变 |
| C、氧化还原反应的实质是元素化合价的升降 |
| D、某元素由化合态转化为游离态,这种元素一定被还原了 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 样品的质量/g | KmnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入催化剂,反应速率加快,反应的也随之改变 |
| B、升高温度,反应速率加快,反应放出的热量不变 |
| C、改变压强,平衡不发生移动,反应放出的热量不变 |
| D、如果将该反应设计成原电池,反应放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 离子交换膜是一类具有离子交换功能的高分子材料,在生产和科研中有广泛应用.一容器被离子交换膜分成左右两部分,如图所示:
离子交换膜是一类具有离子交换功能的高分子材料,在生产和科研中有广泛应用.一容器被离子交换膜分成左右两部分,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
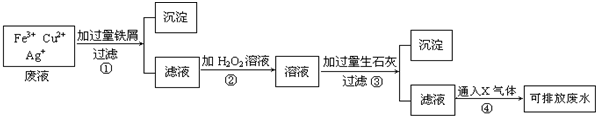
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com