
(1)测定原理:SO2通入碘的淀粉溶液中,则溶液由蓝色变为无色,这是由于碘能氧化SO2,写出这一反应的化学方程式________________________
(2)测定装置如图.

(1) 测定方法①碘溶液的配制:为配制5×10-4mol·L-1的碘溶液,用分析天平准确称取________g粉末状的纯碘,并称取约4g KI(加入KI并不影响I2溶液物质的量浓度的计算),试回答,加入KI的目的是________________________,使之全部溶于水配成1000mL溶液,取此溶液50mL稀释10倍,其操作方法是________________________,即得到5×10-4mol·L-1的碘溶液,注入上图的试管中加2~3滴淀粉指示剂.在测定地点(如硫酸厂炼焦厂、居民集中的住宅区等)按图连接好装置,徐徐抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气的次数.设抽气次数为n,经计算,空气中SO2含量=![]() (mg·L-1).
(mg·L-1).
(2) 空气中SO2允许含量不得超过0.02 mgL-1,则抽气数≥________次时该地点空气才符合标准,否则说明SO2含量超标,已造成空气污染.
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:022
环境监测中,关于空气里SO2含量的测定有如下简易测定法:
(1)测定原理:SO2通入碘的淀粉溶液中,则溶液由蓝色变为无色,这是由于碘能氧化SO2,写出这一反应的化学方程式_____ ___。
(2)规定装置如图。

(3)测定方法:
①碘溶液的配制:为配制5×10-4mol•L-1的碘溶液,用分析天平准确称取________g粉末状的纯碘,并称取约4gKI(加入KI并不影响IZ溶液物质的量浓度的计量),
试回答,加入KI的目的是________,使之全部溶于水配成1000mL溶液,取此溶液50mL稀释10倍,其操作方法是______ __,即得到5×10-4mol•L-1的碘溶液。配好的碘溶液应存放在棕色玻璃瓶于冷暗处。
②测定:用移液管精确吸取5mL 5×10-4mol•L-1的碘溶液,注入图4的试管中,加2~3满淀粉指示剂,此时溶液呈蓝色。在测定地点(如硫酸厂、炼焦厂、居民集中的住宅区等),按图中装置连接好各仪器,徐徐抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气的次数。设抽气次数为n,经计算,空气中SO2的含量=1.6/n(mg•L-1)。空气中SO2允许含量不得超过0.02mg•L-1,则抽气次数n≥________次时该地点空气才符合标准,否则说明SO2含量超标,已造成空气污染。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
(1)测定原理:SO2通入碘的淀粉溶液中,则溶液由蓝色变为无色,这是由于碘能氧化SO2,写出这一反应的化学方程式_____ ___。
(2)规定装置如图。
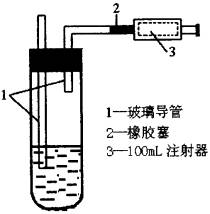
(3)测定方法:
①碘溶液的配制:为配制5×10-4mol•L-1的碘溶液,用分析天平准确称取________g粉末状的纯碘,并称取约4gKI(加入KI并不影响IZ溶液物质的量浓度的计量),
试回答,加入KI的目的是________,使之全部溶于水配成1000mL溶液,取此溶液50mL稀释10倍,其操作方法是______ __,即得到5×10-4mol•L-1的碘溶液。配好的碘溶液应存放在棕色玻璃瓶于冷暗处。
②测定:用移液管精确吸取5mL 5×10-4mol•L-1的碘溶液,注入图4的试管中,加2~3满淀粉指示剂,此时溶液呈蓝色。在测定地点(如硫酸厂、炼焦厂、居民集中的住宅区等),按图中装置连接好各仪器,徐徐抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气的次数。设抽气次数为n,经计算,空气中SO2的含量=1.6/n(mg•L-1)。空气中SO2允许含量不得超过0.02mg•L-1,则抽气次数n≥________次时该地点空气才符合标准,否则说明SO2含量超标,已造成空气污染。
查看答案和解析>>
科目:高中化学 来源:新课标 教材全解 高中化学 配人教版(必修1) 人教版 题型:058
环境监测中,关于空气里SO2含量的测定有如下简易测定法:
(1)测定原理:SO2通入碘的淀粉溶液中,则溶液由蓝色变为无色,这是由于碘能氧化S,写出这一反应的化学方程式________.
(2)测定装置如图所示.

(3)测定方法①碘溶液的配制:为配制5×10-4 mol·L-1的碘溶液,用分析天平准确称取________g粉末状的纯碘,并称取约4 g KI(加入KI并不影响I2溶液物质的量浓度的计量),试回答,加入KI的目的是________,使之全部溶于水配成1000 mL溶液,取此溶液50 mL稀释10倍,其操作方法是________,即得到5×10-4 mol·L-1的碘溶液.配好的碘溶液应存放在棕色玻璃瓶于冷暗处.②测定:用移液管精确吸取5 mL 5×10-4 mol·L-1的碘溶液,注入图中的试管中,加2~3滴淀粉指示剂,此时溶液呈蓝色.在测定地点(如硫酸厂、炼焦厂、居民集中的住宅区等),按图中装置连接好仪器,徐徐抽气,每次抽气100 mL,直到溶液的蓝色全部褪尽为止,记录抽气的次数.设抽气次数为n,经计算,空气中SO2的含量=1.6/n(mg·L-1).空气中SO2允许含量不得超过0.02 mg·L-1则抽气次数n≥________次时该地点空气才符合标准,否则说明SO2含量超标,已造成空气污染.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)量取A mL水样迅速加入固定剂MnSO4溶液与KI碱性溶液,立即塞好胶塞并振荡摇匀,使之反应:2Mn2++O2+4OH-====2MnO(OH)2
(2)滴定:打开胶塞加入适量硫酸即反应:MnO(OH)2+2I-+4H+====Mn2++I2+3H2O
然后用b mol·L-1的NA2S2O3溶液滴定(与I2反应)共消耗V mL(以淀粉为指示剂),其反应是:I2+2![]() ====2I-+
====2I-+![]() 。
。
请回答:
(1)水中溶解氧的质量(mg·L-1)的计算式__________________________。
(2)以淀粉为指示剂,达到终点时,由_________色变为________。
(3)滴定时,滴定管经水洗、蒸馏水洗后立即加入滴定剂NA2S2O3溶液,会导致测定结果_______________。(填“偏高”“偏低”或“无影响”,下同)
(4)滴定前滴定管下端有气泡未排尽,导致测定结果__________________________________。
(5)在记录结果时,滴定前仰视刻度线,滴定后又俯视刻度线,会导致测定结果__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com