
【题目】下列图示与对应的叙述相符的是

A. 图中表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数
B. 实验室用图乙装置滴定FeSO4溶液
C. 实验室用图丙装置脱结晶水得无水硝酸铜固体
D. 图丁表示常温下CaSO4在水中的沉淀溶解平衡曲线,图中a点溶液可通过蒸发变到b点
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:
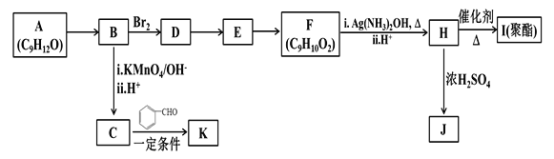
已知以下信息:
①A是芳香族化合物且分子侧链上有处于两种不同环境下的氢原子;
②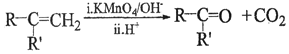
③RCOCH3+RCHO![]() RCOCH=CHR
RCOCH=CHR
回答下列问题:
(1)A生成B的反应类型为________,由D生成E的反应条件为________。
(2)H 的官能团名称为________。
(3)I的结构简式为_______。
(4)由E生成F的反应方程式为________ 。
(5)F有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式为_______。
①能发生水解反应和银镜反应;②属于芳香族化合物且分子中只有一个甲基;
③具有5个核磁共振氢谱峰
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。某种手机电路板中含有以下金属:Sn、Pb、Fe、Cu、Au、Ag、Ni(镍,银白色)、Pd (钯,银白色)。如图是某工厂回收其中部分金属的流程图.(假设流程图中各反应均恰好完全反应.己知:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O)
2CuSO4+2H2O)

(1)步骤②中产生的气体是________(写化学式)。
(2)滤渣2中含有的金属是________
(3)步骤⑤反应的化学方程式________。
(4)步骤⑥回收的纯净物B是________ (写化学式).
(5) 金属Fe、Ni、Pd在溶液中的活动性由强到弱的顺序依次是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A. 23gNa变为Na+时失去的电子数为0.2NA B. 18g水所含的电子数为NA
C. 8g He所含的分子数为NA D. 16g O2与16g O3所含的原子数均是NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。实验结论:A的相对分子质量为_____。
(2)将9.0g A在足量O2中充分燃烧,并使其产物依次缓缓通过足量浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。则A的分子式为_____。
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况)。
实验结论:A中含有的官能团(名称):_____。
(4)A的核磁共振氢谱如图。实验结论:A中含有_____种氢原子。
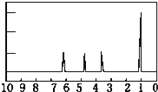
(5)综上所述,A的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种突破传统电池设计理念的镁—锑液态金属储能电池工作原理如下图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。该电池工作一段时间后,可由太阳能电池充电。下列说法不正确的是
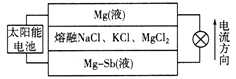
A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为:Mg2++2e—=Mg
C. 该电池充电时,Mg—Sb(液)层发生还原反应
D. 该电池充电时,C1—向中层和下层分界面处移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
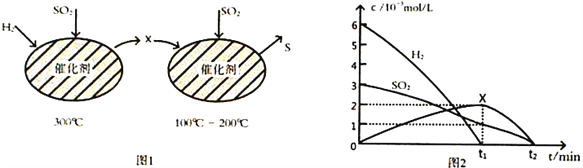
①分析可知X为____________(写化学式),0~t1时间段的温度为_________________,0~t1时间段用SO2 表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
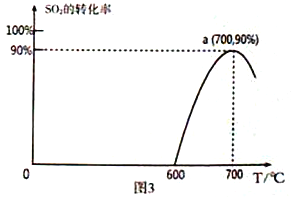
①该反应的ΔH_______________0 (填“>”或“<”)。
②计算a点的平衡常数为_______________________。
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为__________________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com