
| A.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
B.由N2O 4(g)  2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ 2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ |
| C.由:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量为57.3 kJ |
| D.已知101kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221kJ/mol,则1 mol碳完全燃烧放出的热量大于110.5kJ |
 2NO2(g) △H=" -56.9" kJ·mol-1,表明1mol的四氧化二氮完全反应生成2mol的二氧化氮时才能放出56.9 kJ 的热量,但这是一个可逆反应,完全反应是不可能的,因此错误;C、一般来讲,中和热是指稀的强酸与稀的强碱反应生成1mol水的时候所放出的热量,但是对于醋酸来讲,是弱电解质,电离的过程要吸收热量,因此1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量要小于57.3 kJ,错误;D、碳完全燃烧时,生成的是二氧化碳,肯定比生成一氧化碳时放出的热量要多,正确。
2NO2(g) △H=" -56.9" kJ·mol-1,表明1mol的四氧化二氮完全反应生成2mol的二氧化氮时才能放出56.9 kJ 的热量,但这是一个可逆反应,完全反应是不可能的,因此错误;C、一般来讲,中和热是指稀的强酸与稀的强碱反应生成1mol水的时候所放出的热量,但是对于醋酸来讲,是弱电解质,电离的过程要吸收热量,因此1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量要小于57.3 kJ,错误;D、碳完全燃烧时,生成的是二氧化碳,肯定比生成一氧化碳时放出的热量要多,正确。

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
A.已知2H2(g)+O2(g) 2H2O(g) ΔH="-483.6" kJ/mol,则氢气的燃烧热为241.8 kJ 2H2O(g) ΔH="-483.6" kJ/mol,则氢气的燃烧热为241.8 kJ |
B.由C(石墨,s) C(金刚石,s) ΔH="+11.9" kJ·mol-1可知,金刚石比石墨稳定 C(金刚石,s) ΔH="+11.9" kJ·mol-1可知,金刚石比石墨稳定 |
C.同温同压下,H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件的ΔH不同 2HCl(g)在光照和点燃条件的ΔH不同 |
| D.任何一个化学变化都伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
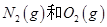 反应生成
反应生成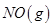 过程中的能量变化,下列说法正确的是
过程中的能量变化,下列说法正确的是
A.通常情况下,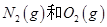 混合能直接生成NO 混合能直接生成NO |
B.1mol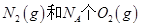 反应放出的能量为180kJ 反应放出的能量为180kJ |
| C.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
D.1mol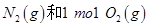 具有的总能量小于2mol 具有的总能量小于2mol 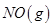 具有的总能量 具有的总能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
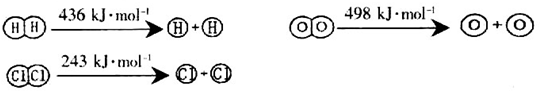
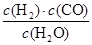 ,它所对应的化学方程式为________________。
,它所对应的化学方程式为________________。 2NH3(g) △H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。
2NH3(g) △H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。 2C(g)+D(s) △H,其化学平衡常数K与T的关系如下表:
2C(g)+D(s) △H,其化学平衡常数K与T的关系如下表:| T/K | 300 | 400 | 500 | …… |
| K/(mol·L-1)2 | 4×106 | 8×107 | 1.2×109 | …… |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

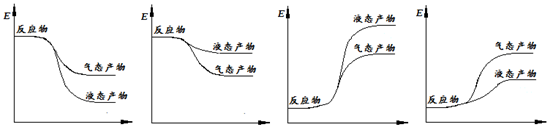
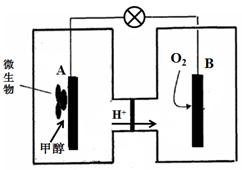
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.键能越大,表示该分子越容易受热分解 |
| B.共价键都具有方向性 |
| C.在分子中,两个成键的原子间的距离叫键长 |
| D.H—Cl的键能为431.8kJ·mol-1,H—Br的键能为366kJ·mol-1,说明HCl比HBr分子稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
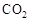 可制取甲醇,其反应为:CO2+3H2
可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
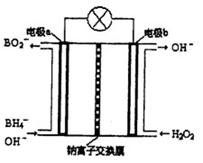
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
B.由C(石墨) C(金刚石) ΔH="+1.9" KJ/mol可知,金刚石比石墨稳定 C(金刚石) ΔH="+1.9" KJ/mol可知,金刚石比石墨稳定 |
| C.1mol H2在足量Cl2中燃烧放热183KJ,则H2的燃烧热为183KJ。 |
| D.在稀溶液中,H+(aq)+OH-(aq)==H2O(l)ΔH="-57.3" kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,整个过程放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑤ | B.②④⑤ | C.②③④ | D.①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com