
| A. | Fe3+ | B. | Al3+ | C. | Na+ | D. | Fe2+ |
分析 溶液中加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,过氧化钠具有强氧化性,Fe2+氧化成Fe3+,减少的是亚铁离子,而铝离子的数目不变,铁离子和钠离子的数目增多,据此进行解答.
解答 解:A.因为Na2O2是强氧化剂,而且遇水生成NaOH,于是Fe2+氧化成Fe3+,并沉淀,再和盐酸反应生成三价铁离子,所以Fe3+浓度增大,故A错误;
B.Na2O2是强氧化剂,而且遇水生成NaOH,铝离子能和过量的氢氧化钠反应生成四羟基合铝酸根离子,在盐酸作用下又会生成铝离子,根据铝元素守恒,则Al3+数目不变,故B错误;
C.过氧化钠与水反应生成氢氧化钠,溶液中钠离子的数目增多,故C错误;
D.因为Na2O2是强氧化剂,而且遇水生成NaOH,且将Fe2+氧化成Fe3+,并沉淀,所以亚铁离子的数目减小,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,题目难度中等,把握过氧化钠的性质、发生的离子反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的应用方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
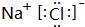 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
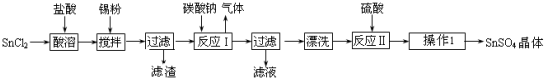
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液盛装在玻璃塞的试剂瓶中 | |
| B. | 新制氯水保存在无色广口瓶中 | |
| C. | 铝片密封保存在细口瓶中 | |
| D. | 金属钠保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
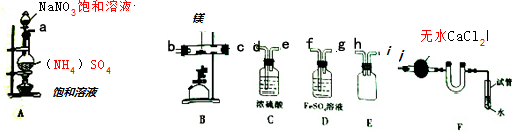
| 空硬质玻璃管质量 | 硬质玻璃管与镁的质量 | 硬质玻璃管与产物的质量 |
| 142.312g | 142.480g | 142.550g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子晶体 | 原子晶体 | 分子晶体 | |
| A | NaOH | Ar | SO2 |
| B | H2SO4 | 石墨 | S |
| C | CH3COONa | 水晶 | 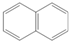 |
| D | Ba(OH)2 | 金刚石 | 玻璃 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| T |
| A. | X、Z、W元素的原子半径以及它们的气态氢化物的热稳定性均依次递增 | |
| B. | YX2晶体熔化、液态WX3气化均需克服分子间作用力 | |
| C. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 | |
| D. | Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com