
【题目】已知NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2.24 L CHCl3 所含共价键数为0.4NA
B.常温常压下,2 g羟基(18OD)所含的中子数为NA
C.常温常压下,1.5 g NO与1.6 g O2充分反应后混合物中原子总数为0.2NA
D.常温下,2 L 0.1 molL-1FeCl3 溶液与1 L 0.2 molL-1FeCl3 溶液所含Fe3+数目相同
【答案】C
【解析】
A.标准状况下,CHCl3 是液体,无法根据气体摩尔体积计算2.24 L CHCl3的物质的量,故A错误;
B.每个18OD所含的中子数为11,2 g羟基(18OD)的物质的量为![]() =0.1mol,则所含的中子数为1.1NA,故B错误;
=0.1mol,则所含的中子数为1.1NA,故B错误;
C.1.5 g NO的物质的量为![]() =0.05mol,1.6 g O2的物质的量为
=0.05mol,1.6 g O2的物质的量为![]() =0.05mol,根据原子守恒,1.5 g NO与1.6 g O2充分反应后混合物中原子总数为(0.05mol×2+0.05mol×2)×NAmol-1=0.2NA,故C正确;
=0.05mol,根据原子守恒,1.5 g NO与1.6 g O2充分反应后混合物中原子总数为(0.05mol×2+0.05mol×2)×NAmol-1=0.2NA,故C正确;
D.Fe3+在不同浓度的溶液中水解程度不一样,则相同温度下,2 L 0.1 molL-1FeCl3 溶液与1 L 0.2 molL-1FeCl3 溶液所含Fe3+数目不可能相同,故D错误;
故答案为C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为探究铁和硫反应产物中铁的化合价,某同学设计了如下所示的实验过程:
![]()
已知:①铁和硫反应产物不溶于碱,能溶于硫酸
②硫可溶于热碱溶液,发生类似于 Cl2 和 NaOH 溶液的化学反应下列说法不正确的是
A.混合粉末应在 N2 氛围中进行加热,所用 H2SO4 溶液应先煮沸
B.取溶液 A,滴加 KSCN 溶液,未出现红色,可证明铁和硫反应只有+2 价铁生成
C.滤渣用稀 H2SO4 溶解时应在通风橱中进行
D.硫溶于热碱溶液可能发生的离子反应是3S+6OH-![]() 2S2-+SO32-+3H2O
2S2-+SO32-+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
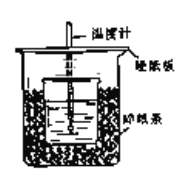
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________________;由图可知该装置有不妥之处,应如何改正?___________________________________________________.
(2)烧杯间填满碎塑料泡沫的作用是__________________________________________.
(3)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求得的中和热数值___________(填“相等、不相等”)
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会____________(填“偏大”、“偏小”、“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为学习了元素性质后,分别设计了如下实验:
(1)甲同学想探究“铝热反应”中熔融物的成份,他查阅《化学手册》得到Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | …… |
①由此甲同学推测,教材中铝热反应所得到的熔融物应是铁铝合金。其理由是:_______________。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝,该实验所用试剂是___,反应的离子方程式为_____。
③甲同学为确定熔融物中是否还会有残留的Fe2O3,将熔融物用酸完全溶解后加入KSCN试剂。请你分析该设计是否正确___(填“正确”或“不正确”),理由是(用离子方程式表示)______________________。
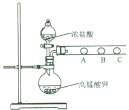
(2) 乙同学设计了如下图装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。乙同学可能观察到的现象有_______。 从环保角度考虑,该装置有明显不足,请提出改进建议_____________________。
(3) 丙同学欲比较N、C、Si的非金属性强弱,设计了下图所示的实验装置,其设计能否达到实验目的______(填“能”或“不能”),理由是______________。 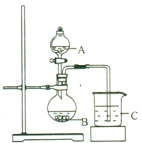
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G各物质间的关系如下图,其中B、D为气态单质。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请回答下列问题:
(1)物质C和E的名称分别为________、________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为__________________________;
若只能在加热情况下进行,则反应物A应为________;
(3)写出D转化为G的化学方程式_____________________________________;
(4)新配制的F溶液应加入________以防止其转化为G。检验G溶液中阳离子的常用试剂是________,实验现象为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3COOH、H2CO3、H2SO3的电离常数如表所示。
酸 | 电离常数 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 ,K2=1.02×10-7 |
请回答下列问题:
(1)①NaHSO3溶液中电荷守恒表达式_____。
②NaHSO3溶液中各离子浓度大小顺序:_____。
(2)①用离子方程式表示Na2CO3溶液碱性的原因_____。
②写出Na2CO3溶液中物料守恒表达式______。
③写出NaHCO3溶液中质子守恒表达式______。
(3)常温下,物质的量浓度相同的下列溶液:
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④NH4HSO4 ⑤(NH4)2Fe(SO4)2
溶液中c(NH4+)从大到小排列顺序为____(填序号)。
(4)常温下,物质的量浓度均为0.1mol/L的六种溶液①NaOH、②NaCl、③Na2CO3、④H2SO3、⑤CH3COONa、⑥H2SO4,pH从大到小排列顺序为____(填序号)。
(5)常温时,AlCl3的水溶液呈酸性,原因是(用离子方程式表示):____,将AlCl3溶液蒸干,灼烧,最后得到的固体产物主要是____(填化学式)。
(6)证明CH3COOH是弱电解质的简单且可行的方法是:_____。
(7)下列混合溶液中,各离子浓度的大小顺序或等量关系正确的是____。
A.10 mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10 mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2 mol/LNaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
E.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质在水溶液中的电离方程式
①H2SO4—____________________;
②Ba(OH)2—____________________;
③NaCl—____________________;
④CuSO4—____________________;
⑤Na2CO3—____________________;
⑥NH4NO3—____________________;
(2)写出下列微粒的结构示意图
①H____________________;
②Na____________________;
③O2-____________________;
④Mg2+____________________;
⑤最外层电子数为次外层电子数2倍的原子____________________;
⑥第二层电子数为第一层、第三层电子数之和的原子:______________________;
⑦氢元素存在着氕氘氚三种原子,它们的原子核内都含有一个质子,中子数分别为0、1、2,请用![]() 表示这三个原子____________________________________,这三种原子的关系是互为_____________。
表示这三个原子____________________________________,这三种原子的关系是互为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年3月24日,中国工程院院士、天津中医药大学校长张伯礼表示,中成药连花清瘟胶囊对于治疗轻型和普通型的新冠肺炎患者有确切的疗效。其有效成分绿原酸的结构简式如图,下列有关绿原酸说法正确的是
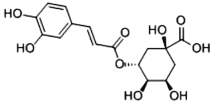
A.最多有 7 个碳原子共面
B.1mol 绿原酸可消耗 5molNaOH
C.不能使酸性高锰酸钾溶液褪色
D.能发生酯化、加成、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(9分)现有含NaCL、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现CL-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
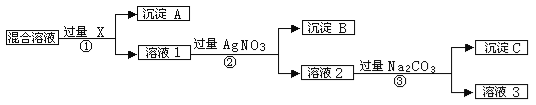
请回答下列问题:
⑴写出实验中下列物质的化学式:试剂X :_______,沉淀A:_______,沉淀B:______。
⑵上述实验流程中加入过量的Na2CO3的目的是___________________________________。
⑶按此实验方案得到的溶液3中肯定含有___________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________ ,之后若要获得固体NaNO3需进行的实验操作是________________(填操作名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com