
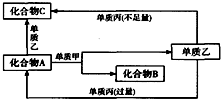
 A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙在如图所示的转化关系(转化过程都不需要使用催化剂).
A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙在如图所示的转化关系(转化过程都不需要使用催化剂).分析 由框图可知,化合物A+单质甲→化合物B+单质乙为置换反应.
(1)A、B、C、甲、乙、丙都有短周期元素组成,甲是常见金属,乙是常见黑色非金属固体单质,考虑乙为C,A、C为无色气体,结合转化关系,可知丙为O2,C为CO,A为CO2,甲为Mg,B为MgO;
(2)单质甲为有色气体,则甲为Cl2,单质乙在常温下是液体,所以乙是液溴,丙是生活中常见的金属,若在溶液中发生,结合转化关系可知,丙为变价金属,可以推出丙是Fe,则A为FeBr2,C为FeBr3,B为FeCl3.
解答 解:由框图可知,化合物A+单质甲→化合物B+单质乙为置换反应.
(1)A、B、C、甲、乙、丙都有短周期元素组成,甲是常见金属,乙是常见黑色非金属固体单质,考虑乙为C,A、C为无色气体,结合转化关系,可知丙为O2,C为CO,A为CO2,甲为Mg,B为MgO,则A与甲反应的化学方程式是:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(2)单质甲为有色气体,则甲为Cl2,单质乙在常温下是液体,所以乙是液溴,丙是生活中常见的金属,若在溶液中发生,结合转化关系可知,丙为变价金属,可以推出丙是Fe,则A为FeBr2,C为FeBr3,B为FeCl3.
①丙(Fe)与C(FeBr3)反应的离子方程式为:Fe+2Fe3+═3Fe2+,
故答案为:Fe+2Fe3+═3Fe2+;
②往A(FeBr2)溶液中逐滴加入NaOH溶液时可能出现的现象是:生成白色沉淀,迅速变成灰绿色,最后变成红褐色,
故答案为:生成白色沉淀,迅速变成灰绿色,最后变成红褐色.
点评 本题考查无机物的推断,根据物质的颜色、状态、特殊反应,结合题干条件进行推断,需要学生熟练掌握元素化合物性质,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的盐酸溶液中含有的阳离子数为0.02NA | |
| B. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| C. | 标准状况下,22.4L CHCl3所含有的分子数目为NA | |
| D. | 27g铝与足量的盐酸或NaOH溶液反应转移的电子数目均为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | a、c两元素处在元素周期表的VIA族 | |
| B. | b、d两种元素可组成化学式为d2b2的化合物,且阴阳离子个数比为1:2 | |
| C. | c单质可在b单质中燃烧生成的化合物的分子式为cb2 | |
| D. | c的单质可用来制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Mg2+、NH3•H2O、Cl-可以大量共存 | |
| B. | 与足量Ba(OH)2溶液反应的离子方裎式:Fe2++SO42-+Ba2++2OH-=Fe(OH)2↓+BaSO4↓ | |
| C. | (NH4)2Fe(SO4)2溶液久置空气中变质的离子方程式:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+ | |
| D. | 向该溶液中滴加适量的酸性KMnO4溶液使其恰好反应溶液褪为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
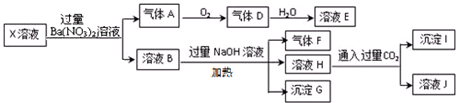
| A. | X中肯定存在Fe2+、A13+、NH4+、C1- | |
| B. | X中不能确定的离子是 K+和C1- | |
| C. | 沉淀G在空气中放置过程中,沉淀颜色会由白色变为灰绿色最后变为红褐色 | |
| D. | 标准状况下将一试管D气体倒扣在水槽中充分吸收(假设所得溶液没有扩散),所得溶液物质的量浓度约为0.036mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2,且均能与水反应 | |
| B. | 根据非金属性强弱,不可能由Z的最高价氧化物制出W的最高价氧化物 | |
| C. | Y的简单氢化物的沸点和热稳定性均大于R的简单氢化物 | |
| D. | 向两份BaCl2溶液中分别通入RY2、WY2,均无白色沉淀生成,但一段时间后,通入RY2的一份中可能产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| B. | 2.0g重水(2H2O)中含有的质子数为1.0 NA | |
| C. | 标准状况下,11.2 LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为NA | |
| D. | 标准状况下,2.24LSO3中含有的O原子的数目为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com