
| m |
| M |
| 1g |
| 44g/mol |
| 1 |
| 44 |
| 1 |
| 44 |
| 44x |
| 3 |
| 44x |
| 3 |


科目:高中化学 来源: 题型:
| A、加热 |
| B、不用铁片,改用铁粉 |
| C、增加H+的浓度 |
| D、不用稀H2SO4,改用98%的浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同质量时消耗的HCl:Na2CO3>NaHCO3 |
| B、相同物质的量时消耗的HCl:Na2CO3>NaHCO3 |
| C、与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3 |
| D、热稳定性:NaHCO3<Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v正>v逆 |
| B、v正<v逆 |
| C、v正=v逆 |
| D、不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[Ag(NH3)2]+、K+、OH-、 |
| B、Fe3+、Cl-、I- |
| C、H+、Al3+、F- |
| D、ClO-、Na+、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH | 6.5~8.5 |
| Ca2+、Mg2+总浓度 | <0.0045mol?L-1 |
| 细菌总数 | <100个/mL |
| 加入凝聚剂 |
| 通入气体A |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
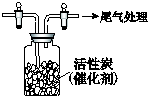 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若金属没有剩余,反应中转移的电子数目为2y NA | ||
| B、若金属全部溶解,则溶液中一定含有Fe3+ | ||
C、当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-
| ||
| D、若金属全部溶解,且产生336mL气体(标准状况),则b=0.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com