
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置 如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素。
B | ||
F |
(1)BF2的结构式为____________。
(2)D和 F氢化物中沸点较高的___________________填化学式)。
(3)工业制取E单质的化学方程式为______________。
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______________。
(5)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入 太空,并且产生三种无污染的气体,其化学方程式为____________。
【答案】 S=C=S H2O 2Al2O3![]() 4Al+3O2↑ 2NH3+3H2O2=N2+6H2O C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑ 。
4Al+3O2↑ 2NH3+3H2O2=N2+6H2O C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑ 。
【解析】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的原子核内无中子,A是H元素,B、F在元素周期表中的相对位置 如图,B与氧元素能形成两种无色气体CO、CO2,故B为C元素;D是地壳中含量最多的元素,D是O元素,C为N元素,E是地壳中含量最多的金属元素,E是Al元素,F为硫元素。
(1)BF2为CS2,碳和硫间形成两个共用电子对,结构式为S=C=S,(2)水分子间形成氢键,H2O比H2S的沸点高,D和 F氢化物中沸点较高的 H2O;(3)工业制取Al单质用电解Al2O3的方法,化学方程式为2Al2O3![]() 4Al+3O2↑ ;(4). 2NH3+3H2O2=N2+6H2O (5)火箭使用B2A8C2作燃料,N2O4为氧化剂,其化学方程式为C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑
4Al+3O2↑ ;(4). 2NH3+3H2O2=N2+6H2O (5)火箭使用B2A8C2作燃料,N2O4为氧化剂,其化学方程式为C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4,在调节溶液pH值时应选用的试剂是
A. NaOH B. NH3·H2O C. ZnO D. Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛。回答下列问题:
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,制取Cu2O的两种方法如下表所示。
方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
方法II | 用肼(N2H4)还原新制Cu(OH)2 |
① 方法I中还原剂与氧化剂的物质的量之比为________。
② 方法II发生反应的化学方程式为______________。
(2)氢化亚铜是一种红色同体,可由下列反应制备:
4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应中每转移3 mol电子,生成CuH的物质的量为___________mol。
(3)氯化铜溶液中各种含铜微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与c(C1-)之间的关系如图所示。

① 当c(C1-)= 9 mol/L时,溶液中3种主要含铜微粒浓度的大小关系为__________。
② 在c(C1-)= l mol /L的氯化铜溶液中,加人AgNO3溶液,CuCl+转化为Cu2+的离子方程式为____________。
(4)已知:Cu(OH)2是二元弱碱,25℃时Ksp[Cu(OH)2]=2.0×10-20。则此温度下在铜盐溶液中Cu2+发生水解反应的平衡常数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人分析一些小而可溶的有机分子的样品,发现它们含有碳、氢、氧、氮等元素,这些样品很可能是
A. 脂肪酸 B. 氨基酸 C. 葡萄糖 D. 核糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,在潮湿空气中易水解氧筑化,且在氯离子浓度较大的体系中存在CuCl+Cl-=[CuCl2]-。工业上用低品铜矿(主要含CuS、Cu2S、FeO等)制备CuCl的一种工艺流程如下:
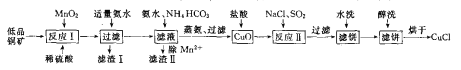
回答下面问题:
(1)反应I中被氧化的元素有_________。(填元素符号)
(2)滤渣II的成分主要为MnCO3,写出除Mn2+的离于方程式_________。
(3)写出反应II中发生反应的离子方程式_________。
(4)在进行反应II时,通入的SO2一般都要适当过量,目的是_________。
(5)滤饼进行醇洗的目的是_________。
(6)在进行反应II时,当氯化钠用量增加到一定程度后氯化亚铜的沉淀率减小,原因是_________。
(7)Cu2+的沉淀率是指转化为CuCl的n(Cu2+)占总的n(Cu2+)的百分比。在一定条件下Cu2+沉淀率与沉淀前的Cl-、Cu2+的物质的量之比[n(Cl-): n(Cu2+)]的关系如下图所示。CuCl+Cl-![]() [CuCl2]-的平衡常数K=6.5×10-2,则该条件下Cu2+的最大沉淀率为_________。(保留两位小数)。
[CuCl2]-的平衡常数K=6.5×10-2,则该条件下Cu2+的最大沉淀率为_________。(保留两位小数)。
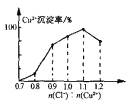
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应能用H++OH-=H2O表示的是
A.氢氧化铜和稀盐酸 B.Ba(OH)2 溶液滴入稀硫酸中
C.澄清的石灰水和稀硝酸反应 D.醋酸和氢氧化钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1。现在850℃时,向2L的密闭容器中充入CO、H2O(g)各4mol,试回答下列问题(写出具体的计算过程):
CO2(g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1。现在850℃时,向2L的密闭容器中充入CO、H2O(g)各4mol,试回答下列问题(写出具体的计算过程):
(1)达平衡时,CO转化率为多少?
(2)H2的体积分数为多少?
(3)若温度仍为850℃,初始时CO浓度为2mol/L,H2O(g)为6mol/L,则平衡时CO转化率为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com