
| A. | 电子云伸展方向与电子的能量大小是无关的 | |
| B. | 只含极性键的分子一定是极性分子 | |
| C. | 氢键是一种特殊的化学键,它广泛地存在于自然界中 | |
| D. | H-O键键能为462.8 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为2×462.8 kJ |
分析 A.电子云伸展方向与电子的能量大小是无关,电子能量越高,电子在离核更远的区域出现概率增大,电子云向更大的空间扩展;
B.含有极性键的分子,结构对称,可能为非极性分子;
C.氢键不属于化学键;
D.化学键断裂吸收能量,化学键形成放出能量,且水分之间存在氢键,也需要消耗能量.
解答 解:A.电子能量越高,电子在离核更远的区域出现概率增大,电子云向更大的空间扩展,电子云伸展方向不变,与电子的能量大小是无关,故A正确;
B.含有极性键的分子,结构对称,可能为非极性分子,若甲烷为极性键形成的非极性分子,故B错误;
C.氢键不属于化学键,故C错误;
D.化学键断裂吸收能量,化学键形成放出能量,且水分之间存在氢键,也需要消耗能量,消耗的能量不等于断键吸收的能量,故D错误.
故选:A.
点评 本题考查核外电子运动、极性分子与非极性分子、氢键、化学变化中能量变化等,注意理解化学键极性与分子极性,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
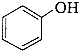
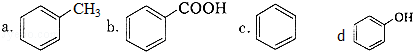
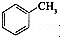 )是一种重要的有机化工原料.
)是一种重要的有机化工原料.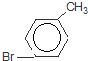 或
或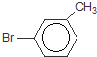 或
或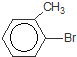 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3 | B. | CH2=CH-CH3 | C. | CH2=CH-CH2-CH3 | D. | CH2=C(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2与NO2 | B. | SO2与O3 | C. | NCl3与BF3 | D. | NH3与SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| B. | 取50mL 18.0mol/L浓硫酸与足量的铜片反应,生成气体分子的数目为0.45NA | |
| C. | 1L 0.1 mol•L-1碳酸钠溶液中,阴离子数目大于0.1NA | |
| D. | 53.5gNH4Cl中存在的共价键总数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com