

分析 (1)Co(CH3COO)2•nH2O在加热过程中首先失去结晶水,A点固体为Co(CH3COO)2,B点剩余的为纯净物,根据题中数据计算出剩余固体的相对分子质量,然后设计成气体的相对分子质量,从而可判断该气体名称、结构简式;
(2)C 为 Co3O4,D 为氧化物,根据D点样品的固体残留率计算出C点固体组成,然后判断其组成,写出固体残留物的化学式及化学方程式.
解答 解:(1)Co(CH3COO)2的相对分子质量为177,设B点剩余固体的相对分子质量为MrB,则:$\frac{{Mr}_{B}}{177}$=$\frac{59.04}{71.08}$,解得:MrB=147,A→B固体减少的物质相对分子质量为177-147=30,因减少的气体是纯净物,则只能为乙烷,B处的剩余固体为CoC2O4,
故答案为:CH3CH3;
(2)C 为 Co3O4,D 为氧化物,设D的相对分子质量为x,则$\frac{32.26}{30.12}=\frac{80.33}{x}$,解得:x=75,故D点固体为CoO,C→D的化学反应方程式为2Co3O4$\frac{\underline{\;\;△\;\;}}{\;}$6CoO+O2,
故答案为:2Co3O4$\frac{\underline{\;\;△\;\;}}{\;}$6CoO+O2.
点评 本题考查化学反应方程式的计算,为高频考点,把握相对分子质量之比等于质量之比为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 根据价层电子对互斥理论知化合物ZX3的空间构型为三角锥形 | |
| B. | Y的电负性比Z的电负性强 | |
| C. | W的氧化物对应的水化物一定是强酸 | |
| D. | 原子半径:W>M>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫、氮氧化物和可入肺颗粒物是雾霾的主要成分,PM2.5 就是指大气中直径小于或等于 2.5 微米的可入肺颗粒物,雾霾都有丁达尔效应 | |
| B. | 屠呦呦最早提出用乙醚提取青蒿素,其提取物抗疟作用达 95%到 100%,这种提取原理就是萃取,属于物理过程 | |
| C. | 硅是一种良好的半导体材料,是制造光导纤维的基本原料 | |
| D. | 工业生产中,常在元素周期表金属与非金属分界线附近寻找催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和 SiO2 | B. | NaCl 和 HCl | ||
| C. | (NH4)2CO3和 CO(NH2)2(尿素) | D. | NaH 和 KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SiC>C(金刚石)>Si | B. | Al>Mg>Na | C. | H2O>H2Se>H2S | D. | KCl>NaCl>LiCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
在密闭容器中进行下列反应:M(g)+N(g) 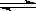 R(g)+2L此反应符合下图,
R(g)+2L此反应符合下图,
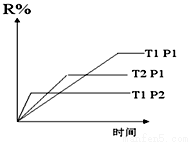
A.正反应吸热,L是气体
B.正反应吸热,L是固体
C.正反应放热,L是气体
D.正反应放热,L是固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com