

| ||
| ||


科目:高中化学 来源: 题型:
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol.L-1 盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 液体体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氨碱法 | 联合制碱法 | ||
| A | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B | 可能的副产物 | 氯化钙 | 氯化铵 |
| C | 循环物质 | 氨气、二氧化碳 | 氯化钠 |
| D | 评价 | 原料易得;设备复杂;能耗高 | 原料利用率高;废弃物少 |
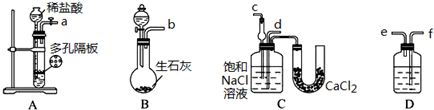
查看答案和解析>>
科目:高中化学 来源: 题型:

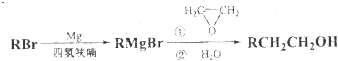
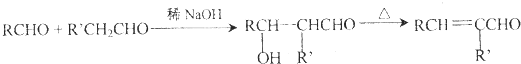
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油裂解、煤的气化、海水制镁都包含化学变化来源 |
| B、福尔马林可制备标本是利用了使蛋白质变性的性质 |
| C、含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 |
| D、红葡萄酒储藏时间长后变香可能是因为乙醇发生了酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
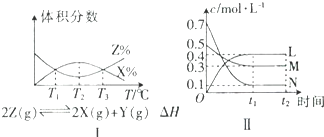
| A、由图Ⅰ可知,该反应在T2时达到平衡 |
| B、由Ⅰ图可知,该反应的△H<0 |
| C、图Ⅱ发生反应的化学方程式为2M+6N?3L |
| D、由图Ⅱ可知,若密闭容器中M、N、L的起始浓度依次为0.4mol/L、0.4mol/L、0.2mol/L,保持其他条件不变,达到平衡时L的浓度为0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
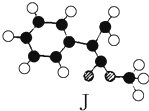 肉桂酸甲酯(H)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基.又知J为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示(图中球与球之间连线表示单键或双键).
肉桂酸甲酯(H)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基.又知J为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示(图中球与球之间连线表示单键或双键).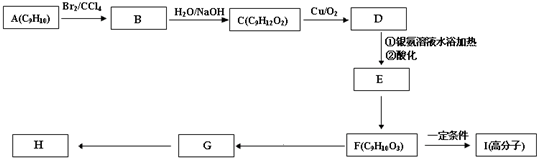
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH溶液保存在配有玻璃塞的细口瓶中 |
| B、金属钠通常密封保存在煤油中 |
| C、氯水保存在无色透明的试剂瓶中 |
| D、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).下列判断正确的是( )
用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).下列判断正确的是( )| A、电解过程中,溶液的pH不断增大 |
| B、当转移0.4mol e-时,电解生成的铜为6.4g |
| C、阳极电极反应式为2H2O+4e-=4H++O2↑ |
| D、Q点对应的气体中,H2与O2的体积比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com