
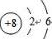 ,故答案为:
,故答案为: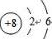 ;
;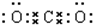 ;化合物C为过氧化钠,过氧化钠为离子化合物,其电子式为:
;化合物C为过氧化钠,过氧化钠为离子化合物,其电子式为: ,其化学式中存在离子键和共价键,
,其化学式中存在离子键和共价键,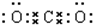 ;直线型;
;直线型; ;离子键和共价键;
;离子键和共价键;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
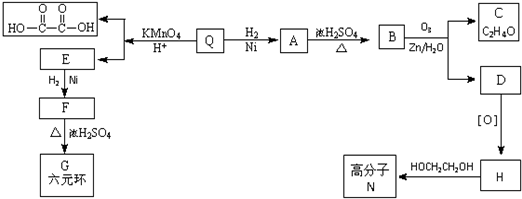
| KMnO4 |
| H+ |
| O3 |
| H2O/Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,48 g O3含有的氧原子数约为3NA |
| B、常温常压下,11.2 L乙烯(C2H4)含有2NA个碳原子 |
| C、1.7 g氨气所含有的电子数目为10 NA |
| D、2.7g铝与足量氢氧化钠溶液反应转移的电子数NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
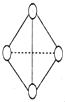 现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.查看答案和解析>>
科目:高中化学 来源: 题型:
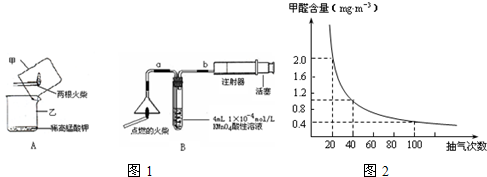
查看答案和解析>>
科目:高中化学 来源: 题型:
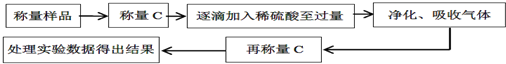
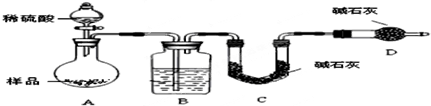
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.784 | B、0.896 |
| C、1.00 | D、1.12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com