
| A. | CuSO4 •5H2O 是混合物 | |
| B. | 含Fe元素质量分数为70%的Fe2O3是纯净物 | |
| C. | 冰和水混合在一起形成混合物 | |
| D. | 由单质形成的物质一定是纯净物 |
 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题

| A. | K2CO3═2K++CO32- | B. | NH4NO3═NH4++NO3- | ||
| C. | H2SO4═2H++SO42- | D. | NH4ClO3═NH4++Cl5++3O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Al溶于稀硝酸中:2Al+6H+═2Al3++3H2↑ | |
| B. | CuH在足量C12中燃烧:2CuH+2Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+H2 | |
| C. | 向复盐NH4Al(S04)2溶液中加入Ba(0H)2至沉淀质量最大:NH4++Al3++4OH-+2SO42-═NH3•H2O+Al(OH)3↓+2BaSO4↓ | |
| D. | 向饱和NaHSO3溶液中加入FeC13溶液:S032-+2Fe3++H20═S042-+2Fe2++2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
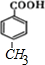 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
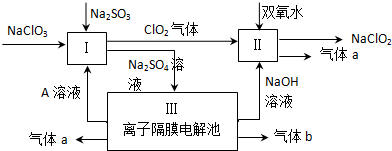
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组利用如下装置合成正丁醛.发生的反应如下:
某实验小组利用如下装置合成正丁醛.发生的反应如下:| 沸点/℃ | 密度/g•cm-3 | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6个碳原子形成的烃分子中,最多有5个C-C单键 | |
| B. | C2H4的结构简式可表示为CH2CH2 | |
| C. | C3H6分子中一定含有C═C双键 | |
| D. | C6H6分子中,所有原子均可能在同一平面内 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com