
| A. | 熔点:SiO2>NaCl>CO2 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 金属性:Na<Mg<Al | D. | 酸性强弱:H2SiO3<H2CO3<HNO3 |
分析 A、晶体熔沸点:原子晶体>离子晶体>分子晶体;
B、元素的非金属性越强,其氢化物的稳定性越强;
C、同周期从左到右金属性减弱;
D、元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:A、晶体熔沸点:原子晶体>离子晶体>分子晶体,所以熔点:SiO2>NaCl>CO2,故A正确;
B、元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S>P,所以氢化物的稳定性HCl>H2S>PH3,故B正确;
C、同周期从左到右金属性减弱,所以金属性:Na>Mg>Al,故C错误;
D、元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性:Si<C<N,所以酸性强弱:H2SiO3<H2CO3<HNO3,故D正确;
故选C.
点评 本题考查元素周期律,侧重考查学生分析推断能力,知道非金属性强弱判断方法、晶体熔沸点高低判断方法,注意最高价氧化物对应水化物的酸性强弱的判断.


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:解答题
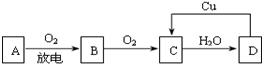
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 在氯化铝溶液中滴加过量的氨水:Al3++4 OH-═[Al (OH)4]- | |
| C. | 在氢氧化钠溶液中通入过量的CO2:2OH-+CO2═CO32-+H2O | |
| D. | 二氧化硅与苛性钠溶液反应:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(C)=0.01 mol/(L•s) | B. | v(C)=0.8 mol/(L•s) | C. | v(C)=0.04 mol/(L•s) | D. | v(C)=0.08 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

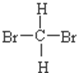 和
和
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
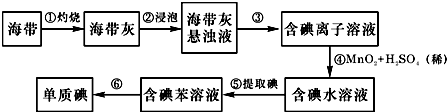
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com