
| A. | 2A+3B═2C | B. | A+3B═2C | C. | 3A+B═2C | D. | 3A+B═C |
分析 同一可逆反应同一时间段内,各物质的反应速率之比等于其计量数之比,把不同物质反应速率转化为同一物质反应速率,从而确定化学式.
解答 解:同一可逆反应同一时间段内,各物质的反应速率之比等于其计量数之比,把不同物质反应速率转化为同一物质反应速率,3v(C)=2v(B),所以v(C)=$\frac{2}{3}$v(B)=$\frac{2}{3}$×3v(A)=2v(A),v(B)=3v(A),所以v(A):v(B):v(C)=v(A):3v(A):2v(A)=1:3:2,故选B.
点评 本题考查化学反应速率与计量数的关系,侧重考查分析计算能力,注意把不同物质反应速率转化为同一种物质反应速率进行比较,题目难度不大.


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2使紫色石蕊溶液变红色:SO2+H2O=2H++SO32- | |
| B. | 利用NaOH溶液除去金属铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O | |
| C. | 向淀粉碘化钾溶液中加稀硫酸,在空气中放置一段时间后变蓝:4H++4I-+O2=2I2+2H20 | |
| D. | 用盐酸洗涤试管中的Cu(OH)2:Cu(OH)2+2H+=Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌片做负极,锌发生氧化反应 | B. | 铜片做正极 | ||
| C. | 溶液中的pH值增大 | D. | 溶液中的H+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
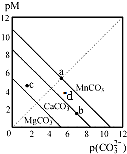 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pX=-lgc(X).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pX=-lgc(X).下列说法正确的是( )| A. | 在该温度下,MgCO3、MnCO3 的溶解度依次增大 | |
| B. | d点可表示MnCO3的过饱和溶液,且c(Mn2+)>c(CO32-) | |
| C. | b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) | |
| D. | c点可表示MgCO3 的不饱和溶液,且c(Mg2+)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) | |
| B. | 1.0 mol•L-1Na2C2O4溶液:c(OH-)=c(HC2O4-)+c(H+)+c(H2C2O4) | |
| C. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| D. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:c(OH-)+c(A-)=c(H+)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CS2熔点高于CO2,其原因是者都为分子晶体,相对分子质量越大,分子间作用力越大
CS2熔点高于CO2,其原因是者都为分子晶体,相对分子质量越大,分子间作用力越大查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com