
| m |
| M |
| n |
| V |
| 2.33g |
| 233g/mol |
| 0.01mol |
| 0.01L |
| 0.08mol |
| 0.01L |
| 1 |
| 2 |


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
| NaOH的质量分数 | 阳极析出物质的质量/g | 阴极析出物质的质量/g | |
| A | 0.062(6.2%) | 19 | 152 |
| B | 0.062(6.2%) | 152 | 19 |
| C | 0.042(4.2%) | 1.2 | 9.4 |
| D | 0.042(4.2%) | 9.4 | 1.2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合溶液中c(K+)=1 mol/L |
| B、上述电解过程中一共转移电子0.8 mol |
| C、电解得到的铜的物质的量为0.2 mol |
| D、电解后溶液中c(H+)=2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
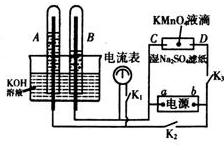 在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极.在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电.
在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极.在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电.查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是:
如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分离四氯化碳和水的混合物用分液漏斗 |
| B、用100 mL的量筒量取5.2 mL的盐酸 |
| C、用托盘天平称取25.20g NaCl |
| D、用100 mL容量瓶配制50 mL 0.1 mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3V正(N2)=V正(H2) |
| B、V正(N2)=2V逆(NH3) |
| C、2V正(H2)=3V逆(NH3) |
| D、V(N2)=3V(H2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com