
| A. | HCl和Ba(NO3)2的混合溶液 | B. | BaCl2溶液 | ||
| C. | NaOH溶液 | D. | Ca(OH)2溶液 |
分析 A.硝酸根离子在酸性环境下能够氧化二氧化硫生成硫酸根离子;
B.盐酸酸性强于亚硫酸;
C.氢氧化钠与二氧化硫生成亚硫酸钠或者亚硫酸氢钠;
D.二氧化硫过量反应生成亚硫酸氢钙.
解答 解:A.HCl和Ba(NO3)2的混合溶液通入二氧化硫反应生成硫酸钡沉淀,故A选;
B.盐酸酸性强于亚硫酸,BaCl2溶液与二氧化硫不反应,故B不选;
C.氢氧化钠与二氧化硫生成亚硫酸钠或者亚硫酸氢钠,二者都易溶于水,故C不选;
D.二氧化硫过量反应生成亚硫酸氢钙,亚硫酸氢钙易溶于水,得不到沉淀,故D不选;
故选:A.
点评 本题考查了元素化合物知识,明确二氧化硫的酸性氧化物、还原性、氧化性是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
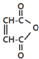 是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径:
是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径: 而不是
而不是 ,即假定苯仍具有普通烯烃的性质,则一分子该“环己三烯”在催化剂作用下与一分子H2发生加成反应后产物分子的结构简式是
,即假定苯仍具有普通烯烃的性质,则一分子该“环己三烯”在催化剂作用下与一分子H2发生加成反应后产物分子的结构简式是 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物必是共价化合物 | |
| B. | 阴、阳离子间通过静电引力所形成的化学键是离子键 | |
| C. | 化学变化过程,一定会破坏旧的化学键,同时形成新的化学键 | |
| D. | 液态氯化氢中存在H+和Cl-,所以能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl和KCl | B. | KCl和NaBr | C. | NaCl和KI | D. | NaCl、KCl和I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
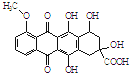 ,有关该物质的说法不正确的是( )
,有关该物质的说法不正确的是( )| A. | 属于芳香族化合物 | |
| B. | 能发生消去反应和酯化反应 | |
| C. | 1 mol该有机物与足量NaOH溶液反应,消耗5 mol NaOH | |
| D. | 能分别与金属Na、NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 元素数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫化钠中加入少量氯化铁S2-+2 Fe3+═2 Fe2++S↓ | |
| B. | 向Na2FeO4溶液中通入氧气和少量亚硫酸溶液10H++2 FeO42-+SO32-+O2═2Fe3++SO42-+5H2O | |
| C. | 用盐酸酸化的高锰酸钾溶液与过氧化氢反应,证明过氧化氢具有还原性:2 MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| D. | 少量SO2通入苯酚钠溶液中2C6H5O-+SO2+H2O═C6H5OH+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com