
| A. | ①②⑤ | B. | ③④⑤ | C. | ②④⑥ | D. | ③⑤⑥ |
分析 ①22.4L氦气温度压强不知,物质的量不是1mol;
②1mol羟基(-16OH)含8mol中子;
③铁参与的氧化还原反应,生成产物中铁元素化合价由+2、+3价,产物中铁元素的化合价不知,转移的电子数无法计算;
④甲酸是电解质,溶液中部分电离,分子数减少;
⑤标准状况下甲醇不是气体;
⑥常温常压,22.4LNO气体物质的量不是1mol,通常情况下,气体摩尔体积大于22.4L/mol,根据气体的物质的量计算其含有的分子数.
解答 解:①22.4L氦气温度压强不知,物质的量不是1mol,不能计算微粒数,故①错误;
②1mol羟基(-16OH)含8mol中子,即8NA个,故②正确;
③56g铁的物质的量为1mol,1mol铁完全反应失去的电子可能为2mol或3mol,所以失去的电子数不一定为3NA个,故③错误;
④甲酸是弱电解质,溶液中部分电离,甲酸分子数减少,100mL 0.5mol•L-1的甲酸溶液中,甲酸的分子数目小于0.05NA,故④正确;
⑤标准状况下甲醇不是气体,22.4LCH3OH物质的量不是1mol,含有的氢原子数不是4NA,故⑤错误;
⑥常温常压,22.4LNO气体物质的量不是1mol,通常情况下,气体摩尔体积大于22.4L/mol,所以22.4LNO气体的物质的量小于1mol,含有的分子数小于NA,故⑥正确,
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,根据分子的构成、气体摩尔体积的应用条件、弱电解质电离平衡、氧化还原反应电子转移等知识来解答,为易错题,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 混合碳酸氢钙与氢氧化钠溶液 | B. | 混合硫酸铝与氢氧化钠溶液 | ||
| C. | 混合浓氨水和硫酸铝溶液 | D. | 混合盐酸和硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
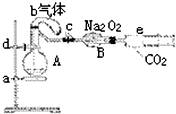 如图所示装置中,a是盛有标况下224mL空气(氧气占五分之一)和10mL 1.2mol/L硝酸的烧瓶,b是未充气(实验开始前内部没有气体)装有0.384g铜粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,e是充有二氧化碳的注射器.整套装置经过气密性检查已合格.
如图所示装置中,a是盛有标况下224mL空气(氧气占五分之一)和10mL 1.2mol/L硝酸的烧瓶,b是未充气(实验开始前内部没有气体)装有0.384g铜粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,e是充有二氧化碳的注射器.整套装置经过气密性检查已合格.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | CO2 | C. | H2S | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| Ⅰ | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式为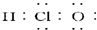 | |
| B. | 将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl | |
| C. | 将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 | |
| D. | 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 mol SO3的体积约为22.4L | |
| B. | 1 mol钠原子中含有的电子数为NA | |
| C. | 常温常压下,17g NH3含氢原子数目为3NA | |
| D. | 1molFe与足量的氯气反应时,转移的电子数是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
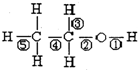
| A. | 乙醇与钠的反应是⑤键断裂 | B. | 乙醇的催化氧化反应是②③键断裂 | ||
| C. | 乙醇与乙酸发生的反应是②键断裂 | D. | 乙醇完全燃烧是①②③④⑤键断裂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com