
已知: NO3-+4H++3e-→NO+2H2O 。现有四种物质:KMnO4、Na2CO3、Cu2O、Fe2(SO4)3,其中能使上述还原过程发生的是 (填化学式),写出该反应化学方程式中氧化产物的化学计量数(写方框内)及其化学式□ 。1mol该物质与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
已知反应:3Cl2+8NH3==N2+6NH4Cl
(1)若有71gCl2参加反应,被氧化的物质是 ;转移电子的物质的量为 mol。
(2)反应后,若产生14g N2,则有 g NH3被氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是________(填字母编号,可多选)。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含纯碱的废水 | 加石灰水反应 | 化学法 |
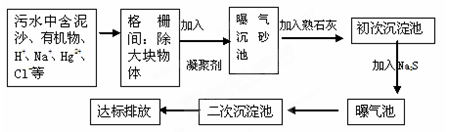
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以下反应①②可用于从不同原料中提取碘:
①2NaI+MnO2+3H2SO4 2NaHSO4+MnSO4+2H2O+I2
2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3 2Na2SO4+3NaHSO4+H2O+I2
2Na2SO4+3NaHSO4+H2O+I2
(1)反应①中的氧化剂是___________________;反应②中的还原产物是________________。
(2)根据反应①②可推知______。
a.氧化性:IO3->SO42- b.氧化性:MnO2>NaIO3
c.还原性:I->Mn2+ d.还原性:I2>NaHSO3
(3)已知NaI和NaIO3在酸性条件下能反应生成I2 ,写出该反应的离子方程式:
③__________________________________________________________。
(4)三个反应中生成等量的I2时转移的电子数最少的是反应________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高锰酸钾是强氧化剂,它的用途遍布各个行业。
(1)工业上由软锰矿(主要成分为MnO2)生产髙锰酸钾分为两个步骤。
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2MnO4),该反应的化学方程式是______________。
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2MnO4)溶液,在_______(填“阴极区”或“阳极区”)得到高锰酸钾。阴极反应的化学方程式是_______。
(2)某研究小组用工业生产高锰酸钾产生的废渣——猛泥(含K2MnO4、MnO2及Pb、Ca等元素)和乳钢废酸液制取工业级碳酸锰(MnCO3),其流程如下: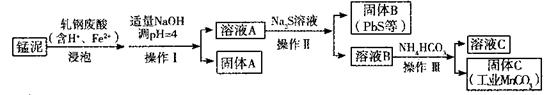
③轧钢废酸中Fe2+的作用是______________。
④操作I、操作II、操作III的名称是_______。
⑤溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是_______。
⑥若固体C中不含CaCO3,则溶液D中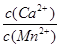 <_______。
<_______。
[已知:Ksp(MnCO3)=1×10—11,Ksp(CaCO3)=5×10—9]
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有:Al2O3.C.N2.AlN.CO
(1)请将AlN之外的反应物与生成物分别填入以下空格内,配平,并标出电子转移的方向和数目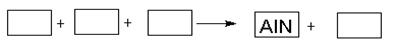
(2)若反应中共转移3.01 ×1023个电子,则该反应产生气体的体积为: (标准状况下)
(3)氮化铝也能由氯化铝与氨气经气相反应制得:AlCl3+NH3  AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
A.前一方法中的 Al2O3.C.N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.前一方法中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:
2FeSO4 + 6Na2O2= 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑
①该反应中的氧化剂是 ,还原剂是 ,每生成l molNa2FeO4转移 mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用 ,
。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式: 。
②每生成1mol FeO42- 转移 mo1电子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量为 mo1。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
铁及其化合物之间的相互转化可用下式表示:
回答下列有关问题:
(1)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是 。
(2)检验硫酸铁溶液中是否存在Fe2+的方法是
(3)
(4)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+。Na2FeO4之所以能净水,除了能消毒杀菌外,另一个原因是(结合离子方程式说明) 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
(1)①连接仪器:把玻璃导管插入橡胶塞的操作是: ,然后对准橡胶塞上得空稍稍用力转动,将其插入。
②检查气体发生装置A的气密性的操作是: ,向分液漏斗中注水,若水不能顺利流下,则气密性良好。
(2)整套实验装置存在一处明显不足,请指出 。
用改正后的装置进行实验。实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化:
D装置中:红色慢慢褪去。
E装置中:CC14层先由无色变为橙色,后颜色逐渐变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因 ,请设计简单实验证明上述解释: 。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com