
【题目】下列各组气体在常温下都不能共存,其中极易发生非氧化还原反应而不能共存的是( )
A.H2S和SO2 B.NO和O2 C.NH3和HCl D.Cl2和H2S
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)

A. C1上发生还原反应
B. Cu电极与C2电极上的电极反应相同
C. M 装置中SO42-移向Cu电极
D. 工作一段时间后装置M 中溶液pH变小,装置N中溶液pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应用电化学原理,回答下列问题:
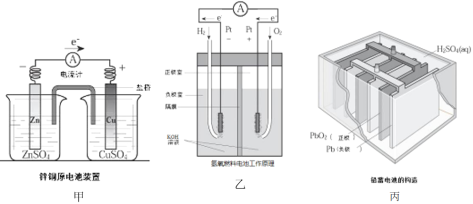
(1)上述三个装置中,负极反应物化学性质上的共同特点是_________。
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是________。
(3)乙中正极反应式为________;若将H2换成CH4,则负极反应式为_______。
(4)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池______极相连接。
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:

ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U型管左侧逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
① 实验ⅰ中银作______极。
② 综合实验ⅰ、ⅱ的现象,得出Ag+和Fe2+反应的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH。
(1)利用如图所示的仪器可以组装实验装置,则仪器的连接顺序是____接D、E接_____、______接_____。
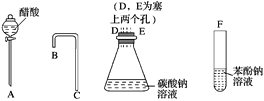
(2)有关反应的化学方程式为________________________________________________。
(3)有的同学认为此装置不能验证H2CO3和C6H5OH的酸性强弱,你认为________(填“有”或“没有”)道理。怎样改进实验才能验证H2CO3和C6H5OH的酸性强弱?
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于有气体参加的反应,一定能使化学反应速率加快的因素是( )
①扩大容器的容积 ②使用正催化剂 ③增加反应物的物质的量 ④升高温度 ⑤缩小容器容积 ⑥增大容器内的压强
A.②③B.②③④⑥C.②④D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷及其化合物在工农业生产中都有重要作用。
(1)基态磷原子价电子排布的轨道表示式为___________。
(2)元素B、N、O的第一电离能由大到小的顺序为___________。
(3)食品添加剂NaNO2中NO2-中心原子的杂化类型是_____,与NO2-互为等电子体的分子的化学式为___________。(写1种)。
(4)N2H4是火箭的燃料,与氧气的相对分子质量相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是____________。
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应合成。
①三溴化磷分子的空间构型是_________,三溴化硼键角是___________。
②磷化硼晶体晶胞如图所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为________,磷原子的配位数为___________,该结构中有一个配位键,提供空轨道的原子是___________。己知晶胞边长apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。

③磷化硼晶胞沿着体对角线方向的投影(图中虚线圆圈表示P原子的投影),用实线圆圈画出B原子的投影位置(注意原子体积的相对大小)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下的定容密闭容器中,进行可逆反应:A(s)+2B(g)![]() C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④B的物质的量浓度。则能表明该反应一定已达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④B的物质的量浓度。则能表明该反应一定已达到平衡状态的是( )
A. 只有④ B. ②③ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W、Q、R是7种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | W | Q | R |
原子半径/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
主要化合价 | +1 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | +1 |
完成下列填空:
(1)上述元素中,金属性最强的在周期表中的位置是________________________________;X、Y、Q各自形成的简单离子中,离子半径由大到小的顺序是_______(填离子符号)。
W和R按原子个数比1﹕4构成的阳离子所含的化学键是____________________。
(2)表中所列4种第三周期元素的最高价氧化物的水化物碱性最弱的是_______(填化学
式),其电离方程式为_____________________________________。
(3)M与Z相比,非金属性较强的是_____________(填元素名称),请从原子结构的角度说明理由_________________________________________________________________。
(4)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应,反应方程式如下:
![]() KMnO4+
KMnO4+![]() H2O2+
H2O2+![]() H2SO4 →
H2SO4 → ![]() K2SO4+
K2SO4+![]() MnSO4+
MnSO4+![]() O2↑+
O2↑+![]() H2O
H2O
请配平,当有0.5 mol H2O2参加此反应,电子转移的个数为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com