
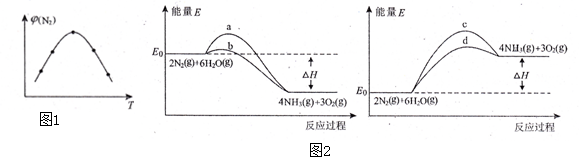
分析 (1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
(2)曲线的变化先增大后变小.我们知道温度升高反应速率加快.在此题中,反应相同时间,低温下的两点是未达到平衡的两点,随温度的升高,氮气的体积分数随温度升高而变大,曲线的最高点是某温度下达到平衡的点,之后的两点,皆是平衡后的氮气的体积分数,且随温度升高而降低,则生成氨气的反应是放热反应;
(3)反应是放热反应,使用催化剂可以降低反应的活化能.
解答 解:(1)上述反应的平衡常数表达式为:K=$\frac{{c}^{4}(N{H}_{3}){c}^{3}({O}_{2})}{{C}^{2}({N}_{2}){C}^{6}({H}_{2}O)}$,故答案为:$\frac{{c}^{4}(N{H}_{3}){c}^{3}({O}_{2})}{{C}^{2}({N}_{2}){C}^{6}({H}_{2}O)}$;
(2)曲线的变化先增大后变小.我们知道温度升高反应速率加快.在此题中,反应相同时间,低温下的两点是未达到平衡的两点,随温度的升高,氮气的体积分数随温度升高而变大,曲线的最高点是某温度下达到平衡的点,之后的两点,皆是平衡后的氮气的体积分数,且随温度升高而降低,则生成氨气的反应是放热反应,即此反应的正反应为放热反应,即Q<0,故答案为:<;
(3)根据(2)的结论,反应是放热反应,应从a、b曲线中找答案,使用催化剂可以降低反应的活化能,因此应该选b,故答案为:b.
点评 本题以人工固氮为载体来考查化学平衡常数、化学反应的热效应、活化能,有一定的综合性,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -69.4kJ•mol-1 | B. | -45.2kJ•mol-1 | C. | +69.4kJ•mol-1 | D. | +45.2kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验.
某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用电解法制备无机高分子聚合物--聚合氯化铝.如图所示,在一定条件下进行,电解总反
用电解法制备无机高分子聚合物--聚合氯化铝.如图所示,在一定条件下进行,电解总反| A. | Cu电极与电源正极相连 | |
| B. | 聚合氯化铝化学式中x=4 | |
| C. | 电解时阴极的电极反应式为:2H++2e?═H2↑ | |
| D. | 将电源换成导线连接两电极,则不能形成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X、Y形成的简单离子,其半径大小关系为W>X>Y | |
| B. | M、W元素形成的简单氢化物的稳定性:W>M | |
| C. | X是同周期中金属性最强的元素 | |
| D. | Z的最高价氧化物对应的水化物的浓溶液能与Y的单质在常温下剧烈反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com