��X��Y��Z�Ƕ�����Ԫ�ص����ֳ��������X��ˮ��Ӧ������һ�־��л�ԭ�ԵIJ��ȶ��Ķ�Ԫ�ᣬ����Ļ�ѧʽ��
H2SO3
H2SO3
��Y��X���Ԫ����ͬ��Y��ˮ��Ӧ����M������M��Ũ��Һ��3.2g Cu�ڼ��������³�ַ�Ӧ�����б���ԭ��M�����ʵ���Ϊ
0.05mol
0.05mol
����̬Z��Ӧ�����˹����꣬0.5mol?L
-1Z��NaOH��Ӧ���õ�����ˮ��Һ�У�����Ũ�ȴӴ�С��˳��Ϊ
C��Na+����C��CO32- ����C��OH-����C��HCO3-����C��H+��
C��Na+����C��CO32- ����C��OH-����C��HCO3-����C��H+��
��
��N
2O
5��һ�������������������ʺ��Ʊ��ܵ����ǵĹ�ע������H
2��O
2��������Na
2CO
3��ɵ�ȼ�ϵ�أ�����YΪCO
2�����õ�ⷨ�Ʊ�N
2O
5���ܵķ�Ӧ����ʽΪ��N
2O
4+2HNO
3=2N
2O
5+H
2��װ����ͼ��ʾ��
д��ʯīI�缫�Ϸ�����Ӧ�ĵ缫��Ӧʽ
H2+CO32--2e-=CO2+H2O
H2+CO32--2e-=CO2+H2O
��
�ڵ���������N
2O
5�ĵ缫��ӦʽΪ
N2O4+2HNO3-2e-=2N2O5+2H+
N2O4+2HNO3-2e-=2N2O5+2H+
��
������������SO
2����������������NO
x���������ǻ�����ѧ�о����ȵ㣮
��1���������������Ի���������
��ֹ���ꡢ�⻯ѧ�����ķ���
��ֹ���ꡢ�⻯ѧ�����ķ���
��
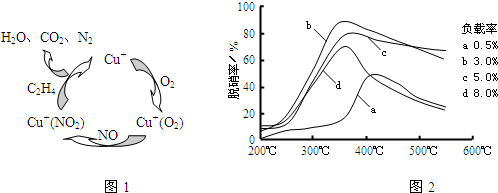
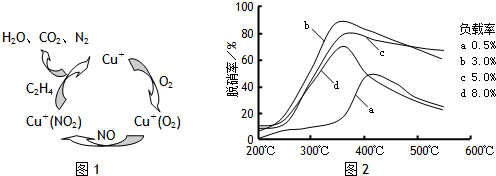
��2��Ŀǰ����ѧ�������о�һ������ϩ��Ϊ��ԭ����������NO��ԭ��������������ʾ��ͼ��ͼ1��

���������¶ȡ������ʣ�����ɸ�д����������������Ĺ�ϵ��ͼ2��ʾ��
��д��������ԭ���ܷ�Ӧ�Ļ�ѧ����ʽ��
6NO+3O
2+2C
2H
43N
2+4CO
2+4H
2O
6NO+3O
2+2C
2H
43N
2+4CO
2+4H
2O
����Ϊ�ﵽ�������Ч����Ӧ��ȡ��������
350�桢������3%
350�桢������3%
��




 ��X��Y��Z�Ƕ�����Ԫ�ص����ֳ��������X��ˮ��Ӧ������һ�־��л�ԭ�ԵIJ��ȶ��Ķ�Ԫ�ᣬ����Ļ�ѧʽ��
��X��Y��Z�Ƕ�����Ԫ�ص����ֳ��������X��ˮ��Ӧ������һ�־��л�ԭ�ԵIJ��ȶ��Ķ�Ԫ�ᣬ����Ļ�ѧʽ��