


科目:高中化学 来源: 题型:阅读理解
| 实验操作 | 预期现象和结论 |
| 步骤1:用药匙取少量白色粉末于试管A底部,点燃酒精灯,充分加热试管. | 白色粉末减少,有白烟生成,试管上部有白色固体凝结,说明原白色粉末含有NH4Cl. 白色粉末减少,有白烟生成,试管上部有白色固体凝结,说明原白色粉末含有NH4Cl. |
| 步骤2: 用药匙取少量试管A中的残留固体于试管B中,滴加适量蒸馏水,振荡. 用药匙取少量试管A中的残留固体于试管B中,滴加适量蒸馏水,振荡. |
固体溶解得无色溶液 固体溶解得无色溶液 |
| 步骤3: 试管B中滴加过量的Ba(NO3)2溶液和1mol?L-1硝酸,充分振荡后静置 试管B中滴加过量的Ba(NO3)2溶液和1mol?L-1硝酸,充分振荡后静置 |
有白色沉淀生成,证明原白色粉末含有K2SO4 有白色沉淀生成,证明原白色粉末含有K2SO4 |
| 步骤4: 取试管B中上层清液少量于试管C中,滴加AgNO3溶液和1mol?L-1硝酸 取试管B中上层清液少量于试管C中,滴加AgNO3溶液和1mol?L-1硝酸 |
有白色沉淀生成,证明原白色粉末含有NaCl 有白色沉淀生成,证明原白色粉末含有NaCl |
| … |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某白色混合物粉末由下表中的部分离子组成:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
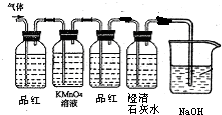
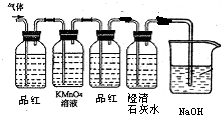
如图甲所示,某同学将一小块钠放在石棉网上加热,观察到生成的产物除了淡黄色固体外还有一些黑色固体物质,当时他想这种黑色物质应该是钠表面吸附的煤油不完全燃烧产生的碳单质,但在学习了镁与C02的反应后,该同学想:就金属活动性而言,Na比Mg还强,该黑色物质是否是Na与C02反应生成的碳单质。为了验证自己的想法,该同学利用装置乙进行实验。
实验步骤如下:①切取一小块金属钠,用滤纸完全吸干煤油,再除去表面的氧化层,放进干燥的E中;
②打开分液漏斗的活塞,使B中的反应进行一段时间后,再点燃E处的酒精灯。
实验现象如下:钠在充满C02气体的玻璃管中剧烈燃烧起来,产生大量的白烟;玻璃管中有黑色物质生成;待玻璃管冷却后,管壁上附着一层白色物质。
请回答下列问题:
(1)C中盛放的试剂是 ,作用是 。D中盛放的试剂是 ,作用是 。
(2)B中的反应进行一段时间后,再点燃E处的酒精灯的目的是 。
(3)该同学将白色物质和黑色物质分别溶于水,发现黑色物质不溶于水,白色物质能溶于水。由此,该同学得出结论,该黑色物质是Na与C02反应生成的碳单质,则其他生成物还应该有 。
(4)请设计一实验方案验证玻璃管内Na与C02反应生成的白色物质的成分,并写出实验步骤、现象和结论 。
(5)若先点燃E处的酒精灯,再打开分液漏斗的活塞,写出此时玻璃管E中可能发生的反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com