
| A. | 3-氯戊烷的分子式为C5H9Cl3 | B. | 3-氯戊烷属于烷烃 | ||
| C. | 3-氯戊烷能发生取代反应 | D. | 3-氯戊烷的同分异构体共有6种 |
科目:高中化学 来源: 题型:选择题
| A. | 制催化剂的材料 | B. | 半导体材料 | ||
| C. | 制农药的材料 | D. | 耐高温、耐腐蚀的合金材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4 mol/(L•min) | |
| B. | 用B表示的反应速率是0.3 mol/(L•min) | |
| C. | 2 min末时的反应速率,用B表示是0.3 mol/(L•min) | |
| D. | 用D表示的反应速率为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
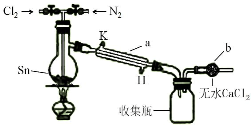 四氯化锡(SnCl4)在电子、化工等领域有重要用途.某兴趣小组拟用Sn和Cl2反应制备SnCl4.
四氯化锡(SnCl4)在电子、化工等领域有重要用途.某兴趣小组拟用Sn和Cl2反应制备SnCl4.| 实验内容 | 实验现象 | 结论 |
| 实验1:滴入KI溶液,再加淀粉溶液 | 溶液最终变为蓝色 | 产品中含有Cl2 |
| 实验2:① | ② | |
| 实验3:③ | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
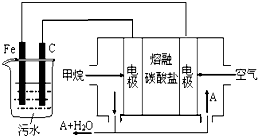
| A. | Fe为阳极,其电极反应为:Fe-3e-+3OH-=Fe(OH)3↓ | |
| B. | 通入甲烷的电极为负极,其电极反应为:CH4-8e-+10OH-=CO32-+7H2O | |
| C. | 为了使该燃料电池长时间稳定运行,电池工作时必须 有部分A物质参加循环.A物质是CO2 | |
| D. | 实验过程中,若在阴极产生了4.48 L气体,则电路中通过的电子个数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯常温下是气体,聚乙烯常温下是固体 | |
| B. | 苯可做有机溶剂 | |
| C. | 乙醇和乙烯都能发生加成反应 | |
| D. | 油脂可用来制造肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
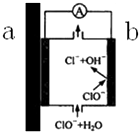 自来水管道经历了从铸铁管→镀锌管→PVC管→PPR热熔管等阶段,铸铁管、镀锌管被弃用的原因之一,可以用原电池原理来解释,示意图如图所示,下列有关说法不正确的是( )
自来水管道经历了从铸铁管→镀锌管→PVC管→PPR热熔管等阶段,铸铁管、镀锌管被弃用的原因之一,可以用原电池原理来解释,示意图如图所示,下列有关说法不正确的是( )| A. | 如果是镀锌管,则a端为Zn,是负极,产生Zn2+,不但会造成管道锈蚀,Zn2+溶于自来水也对人体有害 | |
| B. | b端发生的电极反应为:ClO-+H2O-2e-═Cl-+2OH- | |
| C. | 由于该原电池原理的存在,一定程度上减弱了自来水中余氯的杀菌消毒功能 | |
| D. | 从自来水厂到用户,经过该类管道的长期接触,自来水的酸碱性发生了变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①、④溶液中水电离的c( H+):①>④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②<③ | |
| C. | 将①、④溶液混合后pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 | |
| D. | 分别向等体积的上述溶液中加入100 mL,水,溶液的pH:③>④>①>② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com