
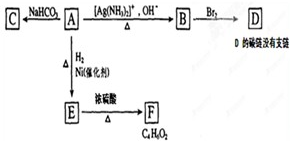
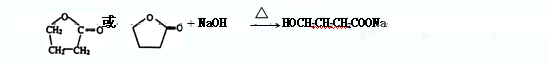 .
.


科目:高中化学 来源: 题型:
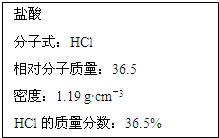 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| AgNO3 | Ba(NO3)2 | AgCl | BaCl2 | |
| H2O(l) | 170g | 9.20g | 1.50×10-4g | 33.3g |
| NH3(l) | 86.0g | 97.2g | 0.80g | 0.00g |
查看答案和解析>>
科目:高中化学 来源: 题型:
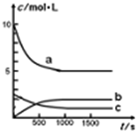 一定温度下,在体积为1L的恒容密闭容器中充入10mol NO2和2.5molO2发生反应:4NO2(g)+O2(g)?2N2O5(g)△H<0.反应混合物中NO2和物质的量浓度随时间的变化如表所示:
一定温度下,在体积为1L的恒容密闭容器中充入10mol NO2和2.5molO2发生反应:4NO2(g)+O2(g)?2N2O5(g)△H<0.反应混合物中NO2和物质的量浓度随时间的变化如表所示:| t/s | 0 | 500 | 1000 | 1500 |
| c(NO2)/mol?L-1 | 10 | 7 | 5 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
 系统命名为
系统命名为
| 一定条件 |
| Ⅰ |
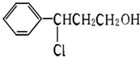
| O2/Cu |
| △ |
| 一定条件 |
| Ⅱ |


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗中的两层液体均从下口放出 |
| B、蒸发食盐溶液,边加热边搅拌,直至把水蒸干得到干燥晶体 |
| C、称量NaOH固体时,将NaOH固体放在托盘天平左盘的纸上 |
| D、配制稀硫酸,在烧杯中加水,沿着烧杯内壁缓慢加入浓硫酸,并用玻璃棒不断搅拌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com