
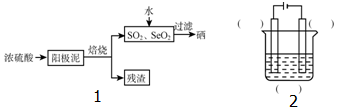
分析 (1)电解精炼铜时粗铜作阳极,纯铜作阴极,CuSO4溶液作电解液;
(2)根据流程图可知硒的氧化产物为SeO2,浓硫酸的还原产物为SO2,由此可得出化学方程式;
(3)根据题中提示H2SeO3是弱酸,在离子方程式中应写化学式;
(4)电解亚硒酸溶液时,阳极发生氧化反应生成硒酸;
(5)根据浓硫酸、二氧化硫的性质分析解答.
解答 解:(1)电解精炼粗铜时,纯铜作阴极,粗铜作阳极,电解质溶液为可溶性的铜盐,可以选用硫酸铜溶液,其图为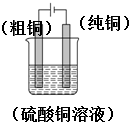 ,
,
故答案为: ;
;
(2)根据流程图可知硒的氧化产物为SeO2,浓硫酸的还原产物为SO2,所以该反应方程式为:Se+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$SeO2↑+2SO2↑+2H2O,
故答案为:Se+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$SeO2↑+2SO2↑+2H2O;
(3)根据题意知,二氧化硫还原亚硒酸生成硒单质,二氧化硫被氧化生成硫酸,离子方程式为:H2SeO3+2SO2+H2O═Se+2SO42-+4H+,
故答案为:H2SeO3+2SO2+H2O═Se+2SO42-+4H+;
(4)根据题意知,阳极上亚硒酸失电子生成硒酸,电极反应式为H2SeO3-2e-+H2O═SeO42-+4H+,
故答案为:H2SeO3-2e-+H2O═SeO42-+4H+;
(5)上述硒的提取过程中用到的浓硫酸具有强腐蚀性,对容器要求较高,且在焙烧的过程中产生二氧化硫等有毒气体,会污染环境,所以要有尾气处理装置,
故答案为:浓硫酸的腐蚀性强或焙烧过程中产生大量有毒气体SO2,污染环境.
点评 本题以电解原理为载体考查了物质的制备,明确制备原理是解本题关键,结合物质的性质分析解答,注意运用题给信息,难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
 现代煤化工产生的H2S是一种重要的工业资源.请回答:
现代煤化工产生的H2S是一种重要的工业资源.请回答:| 分子 | COS | H2 | H2O | CO | H2S | CO2 |
| 能量/KJ/mol | 1323 | 436 | 926 | X | 678 | 1606 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | . 装置可用于除去乙醇中的溴苯 | |
| B. | .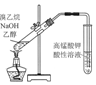 用图所示装置检验溴乙烷与NaOH醇溶液共热产生的C2H4 | |
| C. | .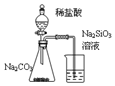 装置可证明非金属性Cl>C>Si | |
| D. | 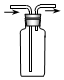 装置可用于收集O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Y>Z | |
| B. | 最高价氧化物对应水化物的酸性:W>X | |
| C. | 单质熔点:X>W>Y | |
| D. | q与p、r的化学键种类完全不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
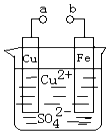
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Fe-3e-═Fe3+ | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 | |
| D. | a和b用导线连接后,铁片上发生还原反应,溶液中铜离子向铜电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:阴离子>阳离子 | B. | 酸性:HClO4>H2SO4 | ||
| C. | 熔沸点:共价化合物>离子化合物 | D. | 稳定性:PH3>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n}{A+16}$(A-N+8)mol | B. | $\frac{n}{A+16}$(A-N+10)mol | C. | $\frac{n}{A}$ (A-N+2)mol | D. | $\frac{n}{A}$(A-N+6)mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com