
����Ŀ����1����2L�ܱ������У���ʼͶ��4 molN2��6molH2��һ������������NH3��ƽ��ʱ���ı��¶Ȳ�õ����������ʾ����֪��T1<T2��
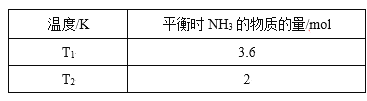
����K1______K2�����>������<����=����ԭ��_______��
����T2�£�����10s�ﵽ��ѧƽ��״̬����0��10s��N2��ƽ������v(N2)Ϊ______��ƽ��ʱH2��ת����Ϊ______������ͬʱ���Ӹ����ʵ���Ϊ1 mol���÷�Ӧ��ƽ��V��_____V����(>��=��<)ƽ�ⳣ����_____�����������С�����䡱��
��������˵���÷�Ӧ�Ѵﵽƽ��״̬����___��
A.3v��H2������2v��NH3���� B.����������ѹǿ����
C.��������ƽ����Է����������ٸı��״̬ D.��H���ֲ���
��2����֪���л�ѧ���ļ���д����ҵ���ư����Ȼ�ѧ����ʽ��
��ѧ�� | H-H | N��N | N-H |
����/kJ��mol-1 | 430 | 936 | 390 |
�Ȼ�ѧ����ʽ��__________��
��3�������ǿ���С����Ƶ�һ����������ԭ��أ����ߵ���Ӱ����Ϊa��b���Ե缫���ֱ��õ������ձ���m��n�����Ե缫�������ӣ�����ԭ��ʾ��ͼ��ͼ��
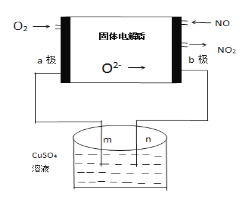
��aΪ___����b���ĵ缫��Ӧʽ____________��
���ڱ�״���£�ͨ��112mL��O2���ɹ۲쵽�ձ���n����_____���ɣ��������ձ��е���Һ�����Ϊ200mL��������䣩���Ӧ��ֹʱ�ձ�����Һ��PHΪ______��
���𰸡��� �¶����ߣ�nNH3�ڼ�С��ƽ�������ƶ�����H��0���¶�����K�ڼ�С 0.05mol/ mol/��L��s�� 50�� �� ���� BC N2(g)+3H2(g) ![]() 2NH3(g)����H=-114kJ/mol �� O2-+NO-2e-=NO2 Cu 1
2NH3(g)����H=-114kJ/mol �� O2-+NO-2e-=NO2 Cu 1
��������
��1����������������������ķ�ӦΪN2(g)+3H2(g) ![]() 2NH3(g)����֪��T1<T2�����ݱ������ݣ��¶����ߣ�n��NH3���ڼ�С��ƽ�������ƶ�����H��0���¶�����K�ڼ�С��K1��K2����Ϊ�������¶����ߣ�n��NH3���ڼ�С��ƽ�������ƶ�����H��0���¶�����K�ڼ�С��
2NH3(g)����֪��T1<T2�����ݱ������ݣ��¶����ߣ�n��NH3���ڼ�С��ƽ�������ƶ�����H��0���¶�����K�ڼ�С��K1��K2����Ϊ�������¶����ߣ�n��NH3���ڼ�С��ƽ�������ƶ�����H��0���¶�����K�ڼ�С��
����T2�£�����10s�ﵽ��ѧƽ��״̬�����ݡ�����ʽ����
N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
��ʼ��mol�� 4 6 0
�仯��mol�� 1 3 2
ƽ�⣨mol�� 3 3 2
��0��10s��N2��ƽ������v(N2)=![]() =0.05mol/��L��s����
=0.05mol/��L��s����
ƽ��ʱH2��ת����Ϊ= ![]() ��
��
����ͬʱ���Ӹ����ʵ���Ϊ1 mol��������������£�����������ϵѹǿ��ƽ���������������С�ķ����ƶ���V����V����ƽ�ⳣ��ֻ���¶��йأ��¶Ȳ���ƽ�ⳣ�����䣻
��Ϊ��0.05mol/ mol/��L��s����50�����������䣻
�۵���Ӧ�еı仯����Ϊ������ʱ���Ѵﵽƽ��״̬�ݴ�
A.��ͬ���ʵ����淴Ӧ����֮�ȵ��ڷ�Ӧ����ϵ��֮�ȣ���Ӧ�ﵽƽ��״̬��v��H2������v��NH3����=3:2 ��Ϊ2v��H2������3v��NH3��������A����
B.����ϵΪ��Ӧǰ�������������ȵ���ϵ��������������ѹǿ���䣬��Ӧ�ﵽƽ��״̬����B��ȷ��
C. ����ϵΪ��Ӧǰ�������ƽ����Է�����������ȵ���ϵ������������ƽ����Է����������ٸı�ʱ����Ӧ�ﵽƽ��״̬����C��ȷ��
D.��Hʼ�ձ��ֲ��䣬������Ϊ�ж�ƽ��״̬�ı�־����D����
��ѡBC��
��2�����ݱ���ѧ���ļ��ܣ���ҵ���ư����Ȼ�ѧ����ʽ��N2(g)+3H2(g) ![]() 2NH3(g) ��H=-114kJ/mol����Ϊ��N2(g)+3H2(g)
2NH3(g) ��H=-114kJ/mol������N2(g)+3H2(g) ![]() 2NH3(g) ��H=-114kJ/mol��
2NH3(g) ��H=-114kJ/mol��
��3������ͼ��ʾ�������ڵ缫a��0�۱�Ϊ-2�ۣ����ϼ۽��͵õ��ӣ�aΪ������b����NO��ΪNO2�����Ļ��ϼ���+2�۱�Ϊ+4�ۣ����ϼ�����ʧ���ӣ�bΪ�������缫��Ӧʽ��O2-+NO-2e-=NO2��
��������O2-+NO-2e-=NO2��
��ԭ��ظ������������������bΪ������nΪ�����������CuSO4��Һ�е�Cu2+�������õ���ת��Ϊ����Cu����ɹ۲쵽�ձ���n����Cu���ɣ���ԭ�����ͨ��112mL��O2��O2���ʵ���Ϊ0.005 mol����ת�Ƶ���0.02 mol�������У�ˮ������ʧ���ӣ��缫ʽΪ��2H2O - 4e- == 4H+ + O2�������ݵ缫ʽ��ת��4 mol��������4 mol H+���ֹ�ת��0.02 mol���ӣ�������0.02mol H+��c(H+)=0.02mol��0.2L=0.1 mol/L���ձ�����Һ��pH=-lg c(H+)=1��
����Cu��1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ--ѡ��5���л���ѧ����]
�����ϩ�����ڼ����������ܿ��پۺ�Ϊ ���Ӷ����н���ԣ�ij�������ϩ������G���ĺϳ�·�����£�
���Ӷ����н���ԣ�ij�������ϩ������G���ĺϳ�·�����£�
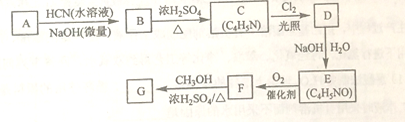
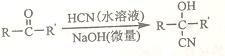
��֪��
��A����Է�����Ϊ58����Ԫ����������Ϊ0.276���˴Ź���������ʾΪ����
��
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ_______��
��2��B�Ľṹ��ʽΪ______����˴Ź���������ʾΪ______��壬�������Ϊ______��
��3����C����D�ķ�Ӧ����Ϊ________��
��4����D����E�Ļ�ѧ����ʽΪ___________��
��5��G�еĹ�������___�� ____ ��_____��������������ƣ�
��6��G��ͬ���칹���У���G������ͬ���������ܷ���������Ӧ�Ĺ���_____�֡������������칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ���ǣ� ��
A. ��ϡ��Һ�У�H2SO4��Ba(OH)2���к���Ҫ����57.3kJ/mol
B. 2C��s��+O2��g���T2CO��g����H ��O����S��O
C. ��֪��2SO2(g) +O2(g)![]() 2SO3 (g) ����H=��98.3kJ/mol����1molSO2��0.5molO2����һ�ܱ������з�Ӧ���ų�49.15kJ������
2SO3 (g) ����H=��98.3kJ/mol����1molSO2��0.5molO2����һ�ܱ������з�Ӧ���ų�49.15kJ������
D. ��10lkPa��25��ʱ��1gH2��ȫȼ��������̬ˮ���ų�120.9kJ����������������ȼ����Ϊ241.8 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ұ߷�Ӧ��ͼ��գ���֪��Ӧ���ǹ�ҵ������������D�ķ�Ӧ����Ӧ����ʵ���Ҽ���������E�ķ�Ӧ����ҵ����ȡƯ�۵ķ�ӦҲ�����С�
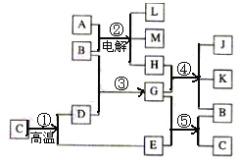
��1������L��_____ ��
��2��������B��____��
��3��ͼ�г���Ӧ�����⣬�����������ڹ�ҵ�����ķ�Ӧ����________��_______������ţ���
��д�����ǵĻ�ѧ��Ӧ����ʽ��____________��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ��������ͭ��Ũ������ȡ��������̽���������ʣ���ش��������⣺
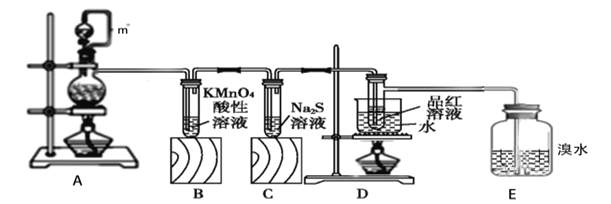
��1��װ��A��m������___��װ��A�������Ե�һ������___��
��2��װ��A�з����Ļ�ѧ��Ӧ����ʽ___���÷�Ӧ������������__________��
��3��װ��B�е�����________��֤��SO2����________��
��4��װ��C����Һ�ڿ����в��ױ��棬ʱ�䳤�˻���ֻ��ǣ�ԭ����_______���������ӷ���ʽ��ʾ��
��5��װ��D��Ŀ����̽��SO2��Ʒ�����õĿ����ԣ�д��ʵ�����������__��
��6��E�е�������___�������Ļ�ѧ��Ӧ����ʽ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ʵ�����мס�����ƿ��ɫ��Һ������һƿ��ϡ���ᣬ��һƿ��̼������Һ��Ϊ�ⶨ�ס�����ƿ��Һ�ijɷּ����ʵ���Ũ�ȣ���������ʵ�飺
����ȡ25.00mL����Һ�������л����μ�����Һ15.00mL�����ռ���224mL����״��������
����ȡ15.00mL����Һ�������л����μӼ���Һ25.00mL�����ռ���112mL����״��������
��1���жϣ�����___��Һ�������ʵ���Ũ��Ϊ___mol/L��
��2��ʵ�������������Ӧ�����ӷ���ʽΪ___��
��.��51.2gCu��ȫ��������Ũ�����У��ռ��������������NO��N2O4��NO2���Ļ�����Щ����ǡ���ܱ�500mL2.0mol/LNaOH��Һ��ȫ���գ����ɺ�NaNO3��NaNO2������Һ��������NaNO3�����ʵ���___��Ҫ���м�������벽�裩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��Ϊ������Ԫ�أ���������Ϊ����Ԫ�أ�һ��Ϊ�ǽ���Ԫ�أ���ԭ�Ӱ뾶�ֱ�Ϊ
X | Y | Z | |
ԭ�Ӱ뾶/nm | 0.154 | 0.130 | 0.071 |
X��Y����ͬһ���ڣ�����Ԫ���γɵļ����Ӿ�����ͬ�ĵ��Ӳ�ṹ������˵����ȷ����
A. ԭ��������������Z>X>Y
B. ����Ԫ�ؿ���Ϊͬ����Ԫ��
C. ԭ��������Y>X>Z
D. ���Ӱ뾶��X>Y>Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽����Һ����Զ�![]() ��Һ�����ƺͱ����Ӱ�졣10mL
��Һ�����ƺͱ����Ӱ�졣10mL![]() ��10mL
��10mL![]() ��Һ�С�
��Һ�С�
I.![]() ��Һ������
��Һ������
��![]() �ֱ�����10mL����ˮ��10mL
�ֱ�����10mL����ˮ��10mL
��Һ��� | �ܼ� | ��Һ��״ | |
�� | ����ˮ | dz��ɫ������Һ�� | �� |
�� |
| ��ɫ������Һ�� | �� |
�� |
| ��ɫ������Һ | �� |
(1)��ƽ���ƶ�ԭ�����͢������Ե���Ҫԭ����________________
(2)�ڡ��۱�췢����Ӧ�����ӷ���ʽ��_______________________
(3)��ͬѧ��Ϊ����һ����+3���������ü������������Һ��,�۲쵽��·:������KSCN�Ģ��е����Լ�a,��Һ���,˵�����ƶ���ȷ���Լ�a��____________
II ![]() ��Һ�ı���
��Һ�ı���
��ʵ��I�����Ƶ�������Һ�ֱ��ڿ����з���24Сʱ��,��¼���¡�
��Һ��� | ��Һ��״ | |
�� | ��ɫ���� | �� |
�� | ��ɫ��Һ | �μ�5�� |
�� | ��ɫ��Һ | �μ�5�� |
���������ۣ��٢�˵�����Լ���ʱ,![]() ��Һ���ױ��ʣ��ڢ�˵������
��Һ���ױ��ʣ��ڢ�˵������
���������ϣ���һ��pH��Χ�ڣ�+2�����Ļ�ԭ�������Լ�������ǿ,�����������������Ե���ǿ����ǿ��
������ʵ�飩����ͼ��ʾװ�����ʵ��(�μ��Լ�ʱ��Һ�������Һ�����Ա仯�ɺ���)�����ҳس����ȶ�ͨ������,��������ʾ���ȶ���:
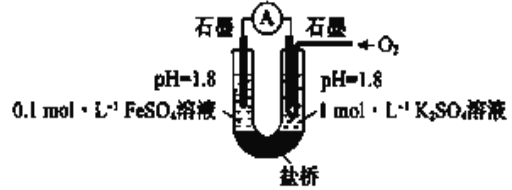
I ����صμ�Ũ������![]() �ӽ�
�ӽ�![]() ������û�����Ա仯
������û�����Ա仯
II ���ҳصμӵ���Ũ���ᣬ������������
(4)��ȫ���������ۣ�:�ڢ�˵��_______________
(5)ii���ҳصĵ缫��Ӧ����ʽ��____________________
(6)����ʵ���ƶϣ��۱Ȣ���![]() ���ױ��ʵ�ԭ����___________________
���ױ��ʵ�ԭ����___________________
(7)������ԭ����װ�����½���ʵ��֤ʵ����![]() ���ױ��ʵ�ԭ��ʵ�鷽����Ԥ��������:���ҳس����ȶ�ͨ������,��������ʾ���ȶ���____________
���ױ��ʵ�ԭ��ʵ�鷽����Ԥ��������:���ҳس����ȶ�ͨ������,��������ʾ���ȶ���____________
(8)����ʵ��,���Ʋ�����![]() ��Һ����ѷ���_________________��
��Һ����ѷ���_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�Ļ�ѧ���������ȷ���ǣ�������
A | Mg(HCO3)2��Һ��������NaOH��Һ��Ӧ | Mg2����2HCO |
B | ����SO2ͨ�뵽NaClO��Һ�У� | SO2��H2O��ClO��===HClO�� |
C | ��Al2(SO4)3��Һ�м��������ϡ��ˮ | Al3 ++4NH3��H2O=AlO2��+4NH4++2H2O |
D | KClO������Һ��Fe��OH��3��Ӧ��ȡK2FeO4 | 3ClO��+2Fe��OH��3��2FeO42��+3Cl��+4H++H2O |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com