

| A、保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大 |
| B、保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| C、保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
| D、保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
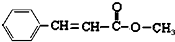
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>②>③ |
| B、③>②>① |
| C、②>①>③ |
| D、③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HS-+H2O?S2++H2O+ |
| B、Fe3++3H2O?Fe(OH)3↓+3H+ |
| C、CO32-+2H2O?H2CO3+2OH- |
| D、NH4++H2O?NH3?H2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2和Ba(HCO3)2 |
| B、AlCl3和NaOH |
| C、NaAlO2和H2SO4 |
| D、Ba(OH)2和NaHSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CaO(或MgO) |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所消耗的硝酸的量:①>②>③ |
| B、对环境造成的危害,③最小 |
| C、因铜与浓硝酸作用最快,故制取硝酸铜的最佳方案是① |
| D、三种途径所消耗的铜的质量不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 | ||||
B、用铜作电极电解稀硫酸,反应Cu+H2SO4
| ||||
| C、铅蓄电池放电时的负极和充电时的阳极均发生还原反应 | ||||
| D、使用催化剂,可加快反应速率,改变反应限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
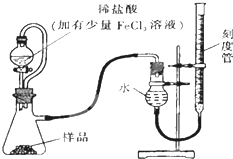 过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com