
【题目】已知HCN、CN在溶液中存在下列平衡,对应的平衡常数分别为K1和K2.①HCNH++CN△H1>0 K1 ②CN+H2OHCN+OH△H2>0 K2,常温下(K1=6.2×1010),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述不正确的是( )
A. K2≈1.6×103 B. 2c(Na+)=c(HCN)+c(CN-)
C. 混合溶液的pH>7 D. 对混合溶液升温, K1增大、K2增大
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
(1)若向装有饱和FeCl3溶液的烧杯中分别滴入下列物质中,能形成胶体的是_______(填序号)。
a.冷水 b.沸水 c.NaOH浓溶液 d.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学方程式:_____________________
(3)用激光笔照射装有Fe(OH)3胶体的烧杯,能在侧面看到一条_________,这种现象称为丁达尔效应
(4)Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是________(填序号)。
a.分散质粒子大小不同 b.颜色不同 c.后者不稳定
(5)若向制得的胶体中再加入稀HCl,红褐色分散系会被破坏,变为黄色溶液,写出相关离子方程式 ____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与阿伏加德罗常数的值(NA)有关的说法正确的是
A. 标准状况下,44.8LHF中含有氢原子的数目为2NA
B. 8.0gCu2S和 CuO的混合物中含有铜原子数为0.1NA
C. 0.2mol·L-1的碳酸钠溶液中CO32-的数目小于0.2NA
D. 1LpH=3的盐酸与1LpH=3的CH3COOH溶液中,水电离出的H+数目均为10-3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 己知化合物N是一种对氨基苯甲酸酯类物质,可作局部麻醉药。合成N的一种路线如下图:

已知以下信息:
①核磁共振氢谱显示B只有一种化学环境的氢,H苯环上有两种化学环境的氢;
②
③E为芳香烃,其相对分子质量为92;
④![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)A的化学名称是_______________,检验B中官能团的试剂是____________,N中官能团的名称是_________________。
(2)由E生成F的化学方程式为____________________________。
(3)由F生成G的反应类型为______________,H在一定条件下可以发生聚合反应,写出该聚合反应的化学方程式:_______________________。
(4)D的同分异构体中不能与金属钠反应生成氢气的共有________种(不考虑立体异构)。
(5)参照上述合成路线,以乙烯、干醚和环氧乙烷为原料(无机试剂任选)制备1,6-已二醛,设计合成路线:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.3g3He含的中子数为2NA
B.28g乙烯(C2H4)和环丁烷(C4H8)的混合气体所含碳原子数为2NA
C.标准状况下22.4LCl2与NaOH溶液完全反应,转移的电子数为2NA
D.1L0.4mol/L盐酸与0.1molMnO2共热后,生成Cl2的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 蔗糖、淀粉、油脂及其水解产物均为非电解质
B. 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
C. 用新制Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖
D. 分子![]() 所有碳原子一定不能共平面
所有碳原子一定不能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的________________。
(2)氯化铝溶液具有净水的作用,原因是(用离子方程式表示):_______________。
(3)已知CO (g) + H2O (g) ![]() CO2 (g) + H2 (g),在800℃时,该反应的化学平衡常数K=1.0,某时刻在一密闭容器中含1.0molCO、1.2mol H2O、0.75molCO2、2mol H2 ,则上述条件下此反应v正________v逆(填“>”“<”或“=”)。
CO2 (g) + H2 (g),在800℃时,该反应的化学平衡常数K=1.0,某时刻在一密闭容器中含1.0molCO、1.2mol H2O、0.75molCO2、2mol H2 ,则上述条件下此反应v正________v逆(填“>”“<”或“=”)。
(4)将25℃下pH=12的NaOH溶液a L与pH=1的HCl溶液b L混合。若所得混合液为中性,则a:b=_____________________。
(5)写出0.1mol/LNaOH溶液1L与标准状况下1.12LCO2完全反应后所得的溶液中各种离子浓度由大到小的顺序为____________________________。
(6)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为________________。用该原电池做电源,常温下,用惰性电极电解200 mL饱和食盐水(足量),消耗标准状况下的CO 的体积为224 mL,则溶液的pH = ___________ 。(不考虑溶液体积的变化)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备Co2O3的工艺流程简图如下:
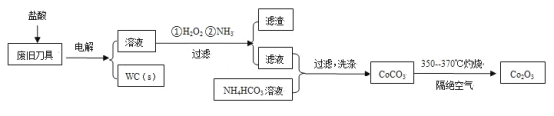
已知:在上述流程中,各种金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Co2+ |
开始沉淀的pH | 1.9 | 7.0 | 6.5 |
沉淀完全的pH | 3.2 | 9.0 | 9.4 |
回答下列问题:
(1)以废旧刀具作阳极,不锈钢作阴极,盐酸为电解质溶液。电解时阳极的电极反应有:Co-2e-=Co2+和______。
(2)通入氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择的pH的范围是_______。
(3)生成CoCO3的离子方程式是________。
(4)实验测得NH4HCO3溶液显碱性。制备CoCO3时,不能将滤液加入NH4HCO3溶液中,原因是_______。
(5)已知:Ksp(CoCO3)=1.4×10-13,Ksp(CoC2O4)=6.3×10-8。若仅从沉淀转化角度考虑,在0.01mol/L Na2C2O4溶液中加入CoCO3固体能否转化为CoC2O4沉淀?通过计算说明:_________。
(6)洗涤CoCO3不充分对最终产品纯度并无影响,但在焙烧时会造成环境污染,主要原因是____。
(7)CoCO3生成Co2O3的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从植物花汁中提取的一种有机物,可简化表示为HIn,在水溶液中因存在下列电离平衡,故可用做酸、碱指示剂:HIn(aq) (红色溶液)![]() H+(aq)+In-(aq) (黄色溶液),在上述溶液中加入下列物质,最终能使指示剂显黄色的是
H+(aq)+In-(aq) (黄色溶液),在上述溶液中加入下列物质,最终能使指示剂显黄色的是
A. HCl B. Na2O2 C. Na2CO3溶液 D. NaHSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com