
【题目】室温下向10mL 0.1mol/L的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减小
B.溶液中 ![]() 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.醋酸的电离常数K随醋酸浓度减小而减小
【答案】B
【解析】解:A、醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,醋酸电离产生的醋酸根离子和氢离子数目增多,故A错误;B、液中 ![]() =K,温度不变,K不变,故B正确;
=K,温度不变,K不变,故B正确;
C、加水稀释,促进电离,醋酸的电离程度增大,但氢离子浓度降低,故C错误;
D、醋酸的电离常数K只和温度有关系,加水稀释醋酸浓度减小,但是K不变,故D错误.
故选B.
【考点精析】利用弱电解质在水溶液中的电离平衡对题目进行判断即可得到答案,需要熟知当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:

(1)写出A、B、C、D、E、F的化学式:
A.__________;B.__________;C.__________;
D.__________;E.__________;F.__________。
(2)写出有关反应的化学方程式(是离子反应的直接写出离子方程式)
B → C:__________________________________________________________________,
E → B:___________________________________________________________________,
C → F:___________________________________________________________________,
F → C:___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙酸乙酯,如图1所示实验装置: 
请回答下列问题:
(1)能完成本实验的装置是(从甲、乙、丙中选填)
(2)试管B中装入的液体为 . 试管B中发生反应的化学方程式为 .
(3)制取乙酸乙酯时加入试剂顺序为 , 发生反应的化学方程式为 .
(4)从制备乙酸乙酯所得的混合物中分离、提纯乙酸乙酯时,需要经过多步操作,下列图2示的操作中,肯定需要的化学操作是(选填答案编号).
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器.使用分液漏斗前必须;某同学在进行分液操作时,若发现液体流不下来,应采取的措施是
(6)用30g乙酸和40g乙醇反应,可以得到37.4g乙酸乙酯,则该实验的产率(产率指的是某种生成物的实际产量与理论产量的比值)是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应8NH3+3Cl2===6NH4Cl+N2,回答下列问题:
(1)该反应的氧化剂是_______________ ,还原剂是________________。
(2)氧化剂与还原剂的物质的量之比为________________。
(3)当有34 g NH3被氧化时,参加反应的氯气的质量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= .
(2)从表中看出,升高温度,K值 , 则CO2的转化率 , 化学反应速率 . (以上均填“增大”“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为℃.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下纯水中的c(H+)=2×10﹣7molL﹣1 , 则此时水中的c(OH﹣)=;若温度不变,滴入稀盐酸,使c(H+)=5×10﹣4molL﹣1 , 则此时溶液中由水电离产生的c(OH﹣)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参照反应Br+H2→HBr+H的能量对反应历程的示意图,下列叙述中正确的是( ) 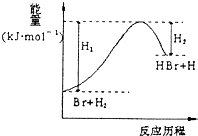
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热不变
C.反应物总能量高于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com