
| A. | ⅦA族元素形成的单质的熔点随元素原子序数增大而升高 | |
| B. | ⅦA族元素易形成-1价离子 | |
| C. | 最高价氧化物的水化物显酸性 | |
| D. | 从上到下气态氢化物的稳定性依次增强 |
分析 ⅦA族元素原子核外最外层电子数为7,同主族元素从上到下,原子半径逐渐增大,元素的金属性逐渐增强,非金属性逐渐减弱,单质的熔点随元素原子序数增大而升高,以此解答.
解答 解:A.F、Cl、Br、I单质的熔点随元素原子序数增大而升高,故A不选;
B.ⅦA族元素原子核外最外层电子数为7,在反应中易得到1个电子形成-1价离子,故B不选;
C.Cl、Br、I的最高价氧化物的水化物均为强酸,显酸性,故C不选;
D.同主族元素从上到下,非金属性逐渐减弱,元素的非金属性越弱,对应的氢化物越不稳定,故D选.
故选D.
点评 本题考查同主族元素的性质的递变规律,侧重于基本概念的理解和运用的考查,注意把握元素周期律的递变规律,难度不大.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:解答题
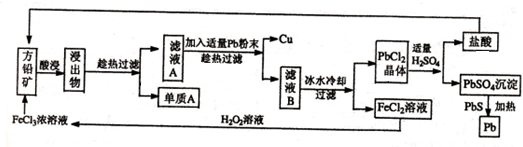
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
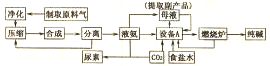
 HCO3-+OH-,溶液显碱性,促进油脂的水解(结合相关离子方程式解释).
HCO3-+OH-,溶液显碱性,促进油脂的水解(结合相关离子方程式解释).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
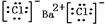 ,⑤的形成过程用电子式表示为
,⑤的形成过程用电子式表示为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸工业发达 | B. | 雷雨天气多 | C. | 机动车辆过多 | D. | 燃料以煤为主 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑥ | C. | ①② | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
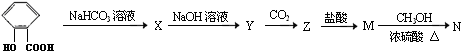
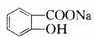 Y
Y M
M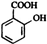 N
N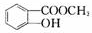
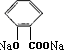 +CO2+H2O→
+CO2+H2O→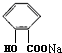 +NaHCO3.
+NaHCO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431kJ | B. | 946 kJ | C. | 649kJ | D. | 869 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com