
近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等,这里的“绿色”是对人类社会可持续发展战略的形象表述。“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是( )
A.Mg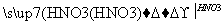 Mg(NO3)2
Mg(NO3)2
B.Mg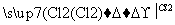 MgCl2
MgCl2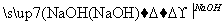 Mg(OH)2
Mg(OH)2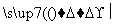 Mg(NO3)2
Mg(NO3)2
C.Mg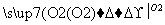 MgO
MgO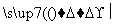 Mg(NO3)2
Mg(NO3)2
D.Mg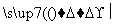 MgSO4
MgSO4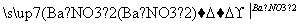 Mg(NO3)2
Mg(NO3)2
科目:高中化学 来源: 题型:
实验室里用二氧化锰与浓盐酸反应来制取适量的氯气,反应方程式为MnO2+4HCl(浓)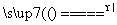 MnCl2+Cl2↑+2H2O。现用100 mL的浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为5.6 L,计算:
MnCl2+Cl2↑+2H2O。现用100 mL的浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为5.6 L,计算:
(1)用双线桥标出电子的转移。
(2)理论上需要参加反应的二氧化锰多少克?
(3)被氧化的HCl的质量为多少克?
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列生成二氧化硫的反应中,反应物中的含硫物质被氧化的是( )
A.硫在空气中燃烧
B.铜片与浓硫酸共热
C.红热的木炭与浓硫酸反应
D.亚硫酸钠与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组欲探究铁及其化合物的氧化性和还原性。请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可少的一种玻璃仪器是______。
(2)请帮助他们完成以下实验报告:
一、实验目的:_______________________________________________________。
二、试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片、KSCN溶液。
三、实验记录(画斜线部分不必填写):
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
| ② | 在FeCl2溶液中加入锌片 | Zn+Fe2+=== Zn2++Fe | ||
| ③ | 在FeCl3溶液中加入足量铁粉 | Fe+2Fe3+===3Fe2+ | Fe3+具有氧化性 | |
| ④ | Fe3+具有氧化性 |
四、实验结论:
Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性。
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有______。(填序号)
A.Cl2 B.Na C.Na+
D.Cl- E.SO2 F.NO2
(4)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化:_________________________________________________,
并简述Fe2+的检验方法:_________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
点燃的镁条在SO2中像在CO2中那样继续燃烧,但反应较镁和CO2反应更为剧烈,反应结束后,在盛SO2的广口瓶中可能存在的生成物是______________(写化学式),反应的化学方程式是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在25 ℃、1.01×105 Pa下,将22 g CO2通入1 mol·L-1 NaOH溶液750 mL中充分反应,测得反应放出x kJ热量。在该条件下,1 mol CO2 通入2 mol·L-1 NaOH溶液1 L中充分反应放出y kJ热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是( )
通入2 mol·L-1 NaOH溶液1 L中充分反应放出y kJ热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是( )
A.CO2(g)+NaOH(aq)====NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1
B.CO2(g)+NaOH(aq)====NaHCO3(aq) ΔH=-(2x-y) kJ·mol-1
C.CO2(g)+NaOH(aq)====NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1
D.CO2(g)+NaOH(l)====NaHCO3(l) ΔH=-(8x-2y) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程中发生取代反应的是
A.乙烯通往Br2的CCl4溶液中生成1,2 ---二溴乙烷
B.乙醇在空气中燃烧生成CO2和H2O
C.用氯乙烯制聚氯乙烯
D.甲烷与氯气混合后光照生成一氯甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)
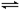 2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
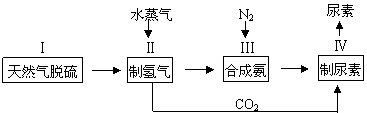 |
(1)步骤II中制氢气原理如下:
CH4(g)+H2O(g)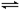 CO(g)+3H2(g) CO(g)+H2O(g)
CO(g)+3H2(g) CO(g)+H2O(g)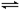 CO2(g)+H2(g)
CO2(g)+H2(g)
恒容容器中,对于以上反应,能加快反应速率的是 。
a. 升高温度 b. 充入He c. 加入催化剂 d. 降低压强
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为 。
(3)CO2和H2在高温、高压、催化剂条件下可合成CH3CH2OH,反应的化学方程式
_________________________________。以CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:_________________________。
(4)已知尿素的结构简式为H2N-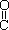 -NH2,请写出尿素的同分异构体中含有离子键的化学式 。
-NH2,请写出尿素的同分异构体中含有离子键的化学式 。
 (5)已知CO2+ 2NH3 CO(NH2)2 + H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成 吨尿素。
(5)已知CO2+ 2NH3 CO(NH2)2 + H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成 吨尿素。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com