
| A. | CaCO3 | B. | BaCO3 | C. | MgCO3 | D. | SrCO3 |
分析 碱土金属离子与碳酸根的极化作用,碱土金属都带两个正电荷,如果离子半径越小对阴离子(碳酸根离子)的极化作用越强,极化作用越强金属键越容易往共价键发展,即越不稳定.所以从第2主族由上到下,极化作用越弱,分解温度越高.
解答 解:碱土金属离子与碳酸根的极化作用,碱土金属都带两个正电荷,如果离子半径越小对阴离子(碳酸根离子)的极化作用越强,极化作用越强金属键越容易往共价键发展,即越不稳定.所以从第2主族由上到下,极化作用越弱,分解温度越高;碱土金属的碳酸盐热分解温度,MgCO3>CaCO3>SrCO3>BaCO3,碳酸盐中最易分解为氧化物的是MgCO3,
故选C.
点评 本题考查酸盐的热分解温度与晶格能的大小关系,学生只要清楚影响晶格能大小的因素,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44g CO2中含有2NA个π键 | |
| B. | 1mol•L-1NaCl溶液含有NA个Na+ | |
| C. | 0.5mol Cu和足量浓硝酸反应可以生成22.4LNO2 | |
| D. | 过量的液溴与铁反应,若反应中消耗1mol铁,则转移的电子数目为2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠溶液显碱性:SO32-+2H2O=H2SO3+2OH- | |
| B. | (NH4)2FeSO4溶液与过量NaOH溶液混合制取氢氧化亚铁:Fe2++2OH-=Fe(OH)2 | |
| C. | NaAlO2溶液中通入过量CO2制取氢氧化铝:2AlO2-+CO2+3H2O=2Al(OH)3+CO32- | |
| D. | 铁红溶于HI酸溶液:Fe2O3+6H++2I-=2Fe2++I2+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体系的压强不再改变 | |
| B. | 体系的温度不再改变 | |
| C. | 消耗1molN2的同时,新生成3molH2 | |
| D. | 反应消耗的N2、H2与产生的NH3的速率υ(N2):υ(H2):υ(NH3)═1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的化学性质不活泼,是因为氮元素不活泼 | |
| B. | 雷雨可以增加土壤中硝酸盐类氮肥的含量,此过程中的反应都属于氮的固定 | |
| C. | 氮气可替代稀有气体作焊接金属的保护气 | |
| D. | NO2溶于水生成硝酸,因此NO2是硝酸的酸酐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2与足量H2O充分反应转移的电子数为2NA | |
| B. | 200mL,1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子总数为6.02×1023 | |
| C. | 已知2A(g)+B(g)═2C(g)△H=-akJ/mol,若将2NA个A与NA个B混合充分反应放出akJ的热量 | |
| D. | 28gSi3N4晶体中含有的硅氮键的数目为2.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
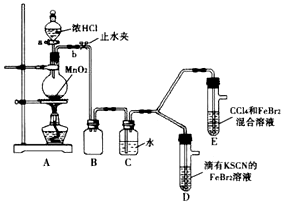
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适置浓盐酸,然后关闭活塞a,点燃酒精灯 | D装罝中:溶液变红,E装置中:水层溶液变黄,振荡后CCl4层无明显变化 | Cl2、Br2、Fe2+的氧化性由强到弱的顺序为Cl2>Br2>Fe3+ |
| i.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2 ii.Cl2和Br2反应生成BrCl,它呈红色(略带黄色)沸点约为5℃,与水发生水解反应 iii.AgClO、AgBrO均可溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
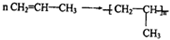
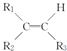 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$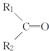 +R3-COOH,
+R3-COOH,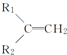 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$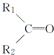 +CO2
+CO2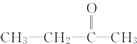 ),则此烯烃的结构简式是CH2=C(CH3)C2H5.
),则此烯烃的结构简式是CH2=C(CH3)C2H5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2约含有6.02×1023个氢分子 | |
| B. | 1 mol H2O的质量为18 g | |
| C. | 1 mol O2的体积为22.4 L | |
| D. | 1L 1 mol/L NaCl溶液中含1 molNa+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com