
| A. | 0.5mol/L K2SO4溶液所含K+数目为NA | |
| B. | 标况下22.4L苯所含分子数目为NA | |
| C. | 56gFe与足量盐酸完全反应时,失去电子数目为NA | |
| D. | 常温常压下,16gO2和O3的混合气体所含原子数目为NA |
分析 A、溶液体积不明确;
B、标况下,苯为液体;
C、求出铁物质的量,然后根据1mol铁与盐酸反应时失去2mol电子来分析;
D、O2和O3均由氧原子构成.
解答 解:A、溶液体积不明确,故溶液中的钾离子的个数无法计算,故A错误;
B、标况下,苯为液体,不能根据气体摩尔体积来计算,故B错误;
C、56g铁物质的量为1mol,而铁与盐酸一后变为+2价,即1mol铁与盐酸反应时失去2mol电子,即2NA个,故C错误;
D、O2和O3均由氧原子构成,则16g混合气体中含有的氧原子的物质的量n=$\frac{16g}{16g/mol}$=1mol,即NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的应用,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 | |
| B. | 二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理相同 | |
| C. | Ksp不仅与难溶电解质的性质和温度有关,而且还与溶液中的离子浓度有关 | |
| D. | 7.8g过氧化钠含有的共用电子对数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

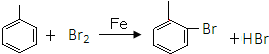 .
. .
.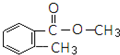 .
. 或
或  的邻、间、对的任意一种.
的邻、间、对的任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰能与水反应,可用来干燥氯气 | |
| B. | 氯化铝是一种电解质,可用于电解法制铝 | |
| C. | 液氨汽化时要吸收大量的热,可用做制冷剂 | |
| D. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
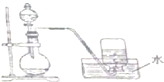
| A. | 氯酸钾和二氧化锰的混合物制取氧气 | |
| B. | 石灰石和盐酸制取二氧化碳 | |
| C. | 浓盐酸和二氧化锰制取氯气 | |
| D. | 铜与稀硝酸反应制取一氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用含有氯化钠的融雪剂会加快桥梁的腐蚀 | |
| B. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水机明矾可以使海水淡化 | |
| C. | 煤经过气化、液化等物理变化可得到清洁燃料 | |
| D. | 棉花、羊毛、木材和草类的主要成分都是纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO42-=BaSO4↓ | |
| B. | 钠与水的反应Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氯气通入氢氧化钠溶液中 2Cl2+2OH-=3Cl-+ClO-+H2O | |
| D. | 大理石溶于醋酸的反应CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究金属铁及其化合物的性质有重要意义.
研究金属铁及其化合物的性质有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com