
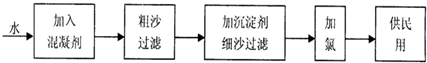
| 1 |
| 4 |
| 0.48mg |
| 0.04L |


科目:高中化学 来源: 题型:
| A、溶液中c(SO42-)为0.1mol/L、c(CO32-) 为0.2mol/L |
| B、该混合物中不含Ba2+、Mg2+ |
| C、一定存在NH4+、K+,无法确定Cl-是否存在 |
| D、实验(3)沉淀中加盐酸后,若只过滤、不洗涤,会对除NH4+外的其他离子含量的测定造成影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
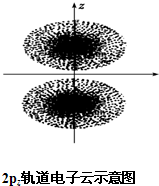 如图是2pz轨道电子云的示意图,请观察图,并判断下列说法中不正确的是( )
如图是2pz轨道电子云的示意图,请观察图,并判断下列说法中不正确的是( )| A、2pz轨道上的电子在空间出现的概率分布是z轴对称 |
| B、点密集的地方表明电子出现的机会多 |
| C、电子先沿z轴正半轴运动,然后在负半轴运动 |
| D、2pz轨道形状为两个椭圆球 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验结论 |
| (1)将混合物溶于水,得到无色透明溶液 | 原混合物肯定无 |
| (2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加入稀硝酸,沉淀不溶解 | 原混合物肯定有 |
| (3)在另一份溶液中加入NaOH溶液,也产生白色沉淀 | 原混合物肯定有 |
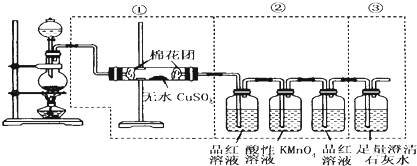
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+Ag+ Ba 2+ A13+Fe3+ |
| 阴离子 | OH - C1- SO42-NO3- CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合溶液的pH=7 | ||
B、若混合溶液中c(H+)=
| ||
| C、若混合溶液pH=4,则水电离出的c(H+)=1.0×10-10mol?L-1 | ||
| D、若HA为强酸,则混合后溶液中各离子浓度的大小关系一定为:c(A-)>c(B+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
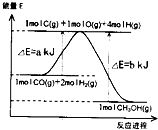 甲醇合成反应为:CO(g)+2H2(g)△CH3OH(g).
甲醇合成反应为:CO(g)+2H2(g)△CH3OH(g).| 10min | 20min | 30min | 40min | 50min | 60min | ||
| 3000C | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 | |
| 5000C | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com