
| A. | b>c | B. | a+b>2c | C. | a+b<c | D. | a+b<2c |
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10 | 0.5 | 20.6 |
| 第二次 | 10 | 4.2 | 24.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBr、CO2、H2O、CS2 | B. | Cl2、Na2S、HCl、SO2 | ||
| C. | NaCl、HCl、H2O、NaOH | D. | Na2O2、H2O2、H2O、O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物具有的总能量总是高于生成物所具有总能量 | |
| B. | 需要加热方能发生的反应一定是吸热反应 | |
| C. | 构成原电池的正极和负极必须是两种不同的金属 | |
| D. | 决定化学反应速率的主要因素是参加反应的物质的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
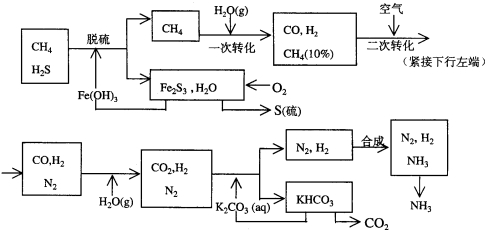
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体分散质粒子较大,不能透过滤纸 | |
| B. | 液态分散系根据分散质粒子大小分为溶液、胶体和浊液三类 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 纳米材料分散到液体分散剂中的分散系属于胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com