
常温下,如果取0.1mol·L-1HA溶液与0.1mol···L-1NaOH溶液等体积混合(不计混合后溶液体积的变化),测得混合液的pH=8,请回答下列问题:
(1)混合后溶液的pH=8的原因(用离子方程式表示): 。
(2)混合溶液中由水电离出的c(H+) (填<、>、=)0.1mol·L-1NaOH溶液中由水电离出的c(H+)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
C(Na+) -c(A-)= mol·L-1,c(OH-)-c(HA)= mol·L-1。
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);将同温下等物质的量浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2CO3 D.NH4Cl
按pH由大到小的顺序排列: (填序号)。
(1)A- + H2O  HA + OH- (2)> (3)9.9 × 10-7, 10-8 (4)> C>A>B>D
HA + OH- (2)> (3)9.9 × 10-7, 10-8 (4)> C>A>B>D
【解析】
试题分析:(1)根据酸碱的用量可知,二者恰好反应。混合后溶液的pH=8,这说明生成的NaA水解,水解的离子方程式是A-
+ H2O  HA + OH-。
HA + OH-。
(2)水解促进水的电离,碱抑制水的电离,则混合溶液中由水电离出的c(H+) >0.1mol·L-1NaOH溶液中由水电离出的c(H+)。
(3)根据电荷守恒可知,C(Na+) +c(H+)=c(OH-)+ c(A-),则C(Na+) -c(A-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L=9.9 × 10-7,mol/L。高考质子守恒可知,c(OH-)=c(HA) +c(H+),则c(OH-)-c(HA)=c(H+)=10-8mol/L。
(4)NH4A溶液为中性,这说明HA和氨水的电离程度是相当。将HA溶液加到Na2CO3溶液中有气体放出,这说明HA的酸性强于碳酸的,所以(NH4)2CO3溶液中CO32-的水解程度大于NH4+的水解程度,(NH4)2CO3溶液的pH>7。由于HCO3-的水解程度小于CO32-的水解程度,所以碳酸氢铵的碱性弱于碳酸铵的,则四种溶液中pH由大到小的顺序排列C>A>B>D。
考点:考查溶液中离子浓度大小比较以及盐类水解的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生晶体能力的培养,意在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是利用好电荷守恒、物料守恒以及质子守恒等。另外还需要特别注意的是,酸碱中和时溶液酸碱性的判断,要首先判断溶液的过量问题,只有当恰好反应时,才能考虑生成的盐是否水解。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 3 |
| 2 |

| c4(H2O) |
| c4(H2) |
| c4(H2O) |
| c4(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 放电 | 充电 |
查看答案和解析>>
科目:高中化学 来源:山东省淄博一中2012届高三上学期期末检测化学试题 题型:022
(1)已知:
Fe(s)+1/2O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
2Al(s)+3/2O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
Al和FeO发生铝热反应的热化学方程式是________.
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如下图所示.
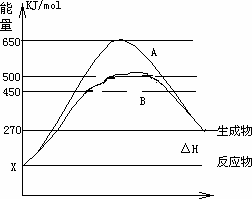
①
据图判断该反应是________(填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率________(填“增大”、“减小”或“不变”)②
其中B历程表明此反应采用的条件为________(选填下列序号字母)A.升高温度
B.增大反应物的浓度
C.降低温度
D.使用了催化剂
(3)1000℃
时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g)①该反应的平衡常数表达式为________.已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”).
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性________
(4)常温下
,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:①
混合溶液中水电离出的c(H+)与0.1 mol·L-1 NaOH溶液中水电离出的c(H+)比较________(填<、>、=).②
已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填<、>、=);相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为________.(填序号)a.NH4HCO3
b.NH4A
c.(NH4)2CO3
d.NH4Cl
查看答案和解析>>
科目:高中化学 来源:江西省高安中学2011-2012学年高二下学期期中考试化学试题 题型:058
按要求回答下列问题
(1)用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是________(填序号)
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
(2)某课外活动小组同学用右图甲装置进行实验,试答下列问题:
①若开始时开关K与a连接,则铁发生电化学腐蚀中的________腐蚀.
②若开始时开关K与b连接,则总反应的离子方程式为________.
(3)已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
①铅蓄电池在放电时负极反应为________,
②铅蓄电池在充电时阳极反应为________;
③如果铅蓄电池在放电时回路中有2 mol电子转移时,消耗H2SO4________mol.
(4)常温下,如果取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字):c(OH-)-c(HA)=________mol/L.
(5)在Cl-、Al3+、HSO4-、K+、HS-五种离子中,只能水解不能电离的离子是________,只能电离不能水解的离子是________,既能电离又能水解的离子是________,写出能水解离子的水解离子方程式________,________.
(6)已知25℃时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,测得某溶液的pH=13,则此温度下溶液中的c(Mg2+)=________.
查看答案和解析>>
科目:高中化学 来源:山东省济南外国语学校2012届高三9月质量检测化学试题 题型:022
常温下
,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:①
混合溶液中水电离出的c(H+)与0.1 mol·L-1 NaOH溶液中水电离出的c(H+)比较________(填<、>、=).②
已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填<、>、=);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为________.(填序号)a.NH4HCO3
b.NH4A
c.(NH4)2CO3
d.NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com