
| m |
| M |
 ;
; ,与氢氧化钠溶液反应生成苯酚钠和水.
,与氢氧化钠溶液反应生成苯酚钠和水.| 2.7g |
| 18g/mol |
| 67.2L |
| 22.4L/mol |
| 3mol |
| 0.5mol |
| 1.5mol×2 |
| 0.5mol |
 ,
, ;
; +Br2
+Br2 | Fe |
 +HBr,
+HBr, +Br2
+Br2 | Fe |
 +HBr;
+HBr;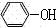 ;
; +3Br2→
+3Br2→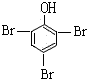 ↓+3HBr,
↓+3HBr, ;白色;
;白色; +3Br2→
+3Br2→ ↓+3HBr;
↓+3HBr; ,
, ;
;

科目:高中化学 来源: 题型:
| A、任何一个氧化还原反应都可以设计为电池,输出电能 |
| B、铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C、电解饱和食盐水的过程中,水的电离平衡正向移动 |
| D、任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子数之比等于2:3 |
| B、原子数之比等于2:3 |
| C、气体物质的量之比等于1:1 |
| D、质量之比等于7:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、2mol | B、4mol |
| C、8mol | D、89.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
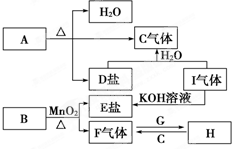 已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G、F是单质,其余均为化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答:(提示:实验室制氧气可用氯酸钾与二氧化锰[作催化剂]混合加热制取)
已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G、F是单质,其余均为化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答:(提示:实验室制氧气可用氯酸钾与二氧化锰[作催化剂]混合加热制取)查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为原电池装置示意图,
如图为原电池装置示意图,查看答案和解析>>
科目:高中化学 来源: 题型:
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸溶液50mL置于右图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸溶液50mL置于右图所示的装置中进行中和热的测定实验,回答下列问题:| 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com