
| A. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 | |
| B. | 乳酸薄荷醇酯(如图 )能发生水解、氧化、消去反应、以及与氢气的加成反应 | |
| C. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| D. | 乙醛和丙烯醛( )不是同系物,它们与氢气充分反应后的产物是同系物 )不是同系物,它们与氢气充分反应后的产物是同系物 |
科目:高中化学 来源: 题型:选择题
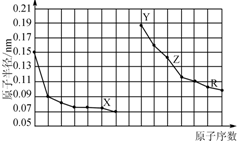
| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.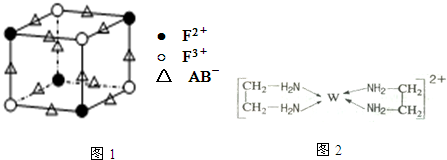
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Q | R | ||
| T | W | ||
| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子结构示意图为 | |
| C. | 与W同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 | |
| D. | W可形成多种含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量NaNO3固体,v(H2)减小 | B. | 20mL BaCl2溶液,v(H2)不变 | ||
| C. | 少量NaHSO4固体,v(H2)不变 | D. | 改用18mol/L的硫酸,v(H2)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
 ;属离子化合物(填“离子”或“共价”).
;属离子化合物(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾溶液具有强氧化性,可用作净水剂 | |
| B. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| C. | 铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| D. | 常温下,铝能被浓硝酸钝化,可用铝制槽车运送浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

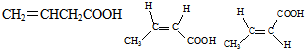 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com