
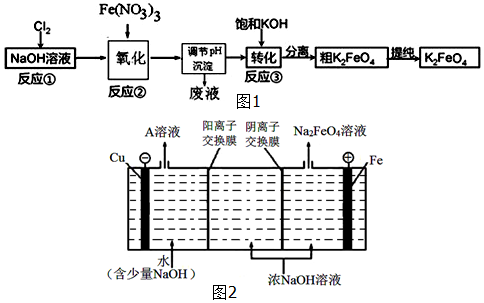
分析 (1)三价铁离子水解产生氢氧化铁胶体,胶体表面积大,吸附能力强,达到净水目的;
(2)(2)Ksp[Co(OH)2]=6.0×10-15,Ksp[Ni(OH)2]=2.0×10-15,对于同种类型的沉淀,Ksp越小,越难溶,则在滴加氢氧化钠溶液的过程中,二价镍离子先沉淀,Ni2++2OH-=Ni(OH)2↓,当Co2+开始沉淀时,溶液中存在两个溶解平衡:Co(OH)2?CO2++2OH-,Ni(OH)2?Ni2++2OH-,根据Ksp[Co(OH)2]计算出此时溶液中c(OH-),则可计算出此时溶液中剩下的镍离子浓度,最终得出溶液中$\frac{c(C{o}^{2+})}{c(N{i}^{2+})}$ 的值;
(3)加入浓KOH溶液可析出高铁酸钾(K2FeO4),说明该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;
Cl2生成ClO-、ClO3-化合价升高,是被氧化的过程,而Cl2生成NaCl是化合价降低被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,据ClO-与ClO3-的物质的量浓度之比可计算出失去电子的总物质的量,进而可计算得到电子的总物质的量;再根据氯元素被还原生成KCl的化合价变化为1计算出被还原的氯元素的物质的量,最后计算出被还原的氯元素和被氧化的氯元素的物质的量之比;
(4)依据阳极是铁,故阳极上铁放电生成FeO42-结合碱性环境来写出电极方程式;根据OH-在阳极被消耗,而在阴极会生成来分析.
解答 解:(1)三价铁离子水解产生氢氧化铁胶体,离子方程式为:Fe3++3H2O?Fe(OH)3(胶体)+3H+,胶体表面积大,吸附能力强,达到净水目的,
故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+;
(2)Ksp[Co(OH)2]=6.0×10-15,Ksp[Ni(OH)2]=2.0×10-15,对于同种类型的沉淀,Ksp越小,越难溶,
则在滴加氢氧化钠溶液的过程中,二价镍离子先沉淀,Ni2++2OH-=Ni(OH)2↓,
当Co2+开始沉淀时,溶液中存在两个溶解平衡:CO(OH)2?CO2++2OH-,Ni(OH)2?Ni2++2OH-,
根据Ksp[Co(OH)2]计算出此时溶液中c(OH-),c(OH-)=$\sqrt{\frac{{K}_{sp}[Co(OH)_{2}]}{c(C{o}^{2+})}}$=$\sqrt{\frac{6.0×1{0}^{-15}}{0.6}}$=10-7mol/L,
则溶液中剩下的镍离子浓度c(Ni2+)=$\frac{{K}_{sp}[Ni(OH)_{2}]}{{c}^{2}(O{H}^{-})}$=$\frac{2.0×1{0}^{-15}}{(1{0}^{-7})^{2}}$=0.2mol/L,溶液中$\frac{c(C{o}^{2+})}{c(N{i}^{2+})}$=$\frac{0.6mol/L}{0.2mol/L}$=3,
故答案为:3;
(3)加入浓KOH溶液可析出高铁酸钾(K2FeO4),说明该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小,
Cl2生成ClO-与ClO3-是被氧化的过程,化合价分别由0价升高为+1价和+5价,
经测定ClO-和ClO3-物质的量之比为1:2,
则可设ClO-为1mol,ClO3-为2mol,被氧化的氯元素的物质的量为:1mol+2mol=3mol,
根据化合价变化可知,反应中失去电子的总物质的量为:1mol×(1-0)+2mol×(5-0)=11mol,
氧化还原反应中得失电子数目一定相等,则该反应中失去电子的物质的量也是11mol,
Cl2生成KCl是被还原的过程,化合价由0价降低为-1价,
则被还原的Cl的物质的量为:$\frac{11mol}{1-0}$=11mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为11mol:3mol=11:3,
故答案为:该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;11:3;
(4)阳极是铁,故阳极上铁放电生成FeO42-,由于是碱性环境,故电极方程式为:Fe+8OH--6e-=FeO42-+4H2O,
在电解时,水电离的H+在阴极放电:2H++2e-=H2↑,c(OH-)增大,Na+通过阳离子交换膜进入阴极区,使阴极区c(NaOH)增大,故NaOH可以循环使用,
故答案为:Fe+8OH--6e-=FeO42-+4H2O.
点评 本题考查了三价铁离子与Na2FeO4的净水原理,涉及难溶电解质的计算、氧化还原反应方程的书写、计算、电极反应的书写,综合性强,有一定难度,Na2FeO4的净水是常考点,应注意归纳总结.


科目:高中化学 来源: 题型:解答题
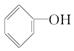 B.
B.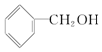 C.CH3 CH2-O-CH2CH3 D.CH3 OH E.CH3-O-CH3 F.HO-CH2CH2-OH
C.CH3 CH2-O-CH2CH3 D.CH3 OH E.CH3-O-CH3 F.HO-CH2CH2-OH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 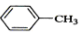 +Cl2$\stackrel{光照}{→}$ +Cl2$\stackrel{光照}{→}$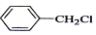 +HCl +HCl | |
| B. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | ClCH2CH=CH2+NaOH→HOCH2CH=CH2+NaCl | |
| D. | 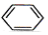 +HONO2$\stackrel{浓硫酸}{→}$ +HONO2$\stackrel{浓硫酸}{→}$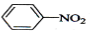 +H2O +H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.3 mol/L | D. | 0.4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含2molFeBr2的溶液中通入1molCl2:2Fe2++Cl2═2Cl-+2Fe3+ | |
| B. | 向AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用焰色反应鉴别NaCl、KCl溶液 | |
| B. | 用氢氧化钠鉴别MgCl2溶液、AlCl3溶液 | |
| C. | 利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用澄清石灰水鉴别SO2、CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
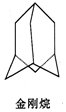 金刚烷结构如图,其结构非常对称,1H-NMR谱中只有两个信号.
金刚烷结构如图,其结构非常对称,1H-NMR谱中只有两个信号.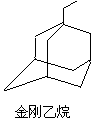 $→_{I}^{Cl_{2}}$M$→_{II}^{NH_{3}}$
$→_{I}^{Cl_{2}}$M$→_{II}^{NH_{3}}$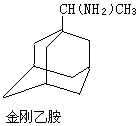
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将某溶液中加入盐酸,有气体生成,气体能使澄清石灰水变浑浊 | 该溶液中有CO32- |
| B | 向某溶液中加入氯化钡溶液生成白色沉淀,再加稀硝酸,白色沉淀不消失 | 该原溶液一定含有SO42- |
| C | 下层液体从分液漏斗下端管口放出后,关闭活塞,换一个接收容器,再将上层液体从下端管口放出 | 取出分液漏斗中的上层液体 |
| D | 向某溶液中加入NaOH溶液并加热,有气体产生,用湿润的红色石蕊试纸,试纸显蓝色 | 说明该溶液中一定含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com