
在 某温度时,测得纯水中[H+]=2.0×10-7 mol·L-1,则[OH-]为( )
某温度时,测得纯水中[H+]=2.0×10-7 mol·L-1,则[OH-]为( )
A.2.0×10-7 mol·L-1
B.0.1×10-7 mol·L-1
C.1.0×10-14/2.0×10-7 mol·L-1
D.无法确定
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
请订正下面的错误。
(1)硫在足量氧气中燃烧:2S+3O2===2SO3。
________________________________________________________________________。
(2)AlCl3溶液呈酸性的原因:Al3++3H2O===Al(OH)3↓+3H+。
________________________________________________________________________。
(3)NaOH溶液与稀硫酸反应的离子方程式:2H++2OH-===2H2O。
________________________________________________________________________。
(4)工业合成氨反应:N2+3H2 2NH3。
2NH3。
________________________________________________________________________。
(5)工业上用氧化铝为原料制备金属铝:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
________________________________________________________________________。
(6)NH4Cl溶液和NaOH溶液加热反应:NH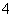 +OH-NH3·H2O。
+OH-NH3·H2O。
________________________________________________________________________。
(7)钢铁吸氧腐蚀,正极的电极反应:O2+2H2O===4OH-+4e-。
________________________________________________________________________。
(8)实验室制取氯气的离子方程式:MnO2+4HCl===MnCl2+Cl2↑+2H2O。
________________________________________________________________________。
(9)铜与浓硝酸反应:Cu+4HNO3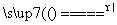 Cu(NO3)2+2NO2↑+2H2O。
Cu(NO3)2+2NO2↑+2H2O。
________________________________________________________________________。
(10)1 g肼气体燃烧生成氮气和水蒸气,放出热量16.7 kJ。反应的热化学方程式:N2H4+O2===N2+2H2O
ΔH=+16.7 kJ。
________________________________________________________________________。
(11)用惰性电极电解硫酸铜溶液的离子方程式:
2Cu2++4OH-===2Cu+O2↑+2H2O。
________________________________________________________________________。
(12)Ba(OH)2溶液与稀硫酸反应的离子方程式:
Ba2++OH-+H++SO ===BaSO4↓+H2O。
===BaSO4↓+H2O。
________________________________________________________________________。
(13)铝—海水电池的负极反应式:Al-3e-+4OH-===AlO +2H2O。
+2H2O。
________________________________________________________________________。
(14)碳酸氢钠在水中电离:NaHCO3Na++H++CO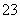 。
。
________________________________________________________________________。
(15)HCO 的水解方程式:HCO
的水解方程式:HCO +H2OH3O++CO
+H2OH3O++CO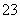 。
。
________________________________________________________________________。
(16)NaHSO4熔化时电离方程式:NaHSO4===Na++H++SO 。
。
________________________________________________________________________。
(17)NH4Cl溶液呈酸性的原因:NH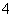 +H2ONH4OH+H+。
+H2ONH4OH+H+。
________________________________________________________________________。
(18)铜与浓硫酸反应:Cu+2H2SO4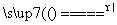 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
________________________________________________________________________。
(19)NH4Cl固体和消石灰加热制NH3:2NH4Cl+Ca(OH)2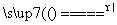 CaCl2+2NH3↑+H2O。
CaCl2+2NH3↑+H2O。
________________________________________________________________________。
(20)实验室制Cl2:4HCl(浓)+MnO2===MnCl2+Cl2↑+2H2O。
________________________________________________________________________。
(21)实验室利用H2O2分解制O2:2H2O2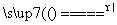 2H2O+O2↑。
2H2O+O2↑。
________________________________________________________________________。
(22)1 g氢气在足量氧气中燃烧生成液态水时,放出热量142.9 kJ,热化学方程式可表示为
 H2(g)+
H2(g)+ O2(g)
O2(g)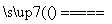
 H2O(l) ΔH=-142.9 kJ。
H2O(l) ΔH=-142.9 kJ。
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应与Na2O2+SO2—→Na2SO4相比较,Na2O2的作用相同的是( )
A.2Na2O2+2CO2—→2Na2CO3+O2
B.2Na2O2+2SO3—→2Na2SO4+O2
C.Na2O2+H2SO4—→Na2SO4+H2O2
D.3Na2O2+Cr2O3—→2Na2CrO4+Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
当CH3COOH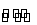 H++CH3COO-已达平衡,若要使醋酸的电离度和溶液的pH都减小,应加入的试剂是( )
H++CH3COO-已达平衡,若要使醋酸的电离度和溶液的pH都减小,应加入的试剂是( )
A.CH3COONa B.NH3·H2O C.HCl D.H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
水是一种极弱的电解质,在常温下平均每n个水分子只有1个分子发生电离,n的值是( )
A.1×1014 B.55.6×107
C.1×107 D.55.6
查看答案和解析>>
科目:高中化学 来源: 题型:
1,3丁二烯和2丁炔分别与氢气反应的热化学方程式如下:
CH2===CH—CH===CH2(g)+2H2(g)—→CH3CH2CH2CH3(g)+236.6 kJ
CH3—C≡C—CH3(g) + 2H2(g)—→CH3CH2CH2CH3(g)+272.7 kJ
由此不能判断
A.1,3丁二烯和2丁炔稳定性的相对大小
B.1,3丁二烯和2丁炔分子储存能量的相对高低
C.1,3丁二烯和2丁炔相互转化的热效应
D.一个碳碳叁键的键能与两个碳碳双键键能之和的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式书写正确的是( )
A.2SO2+O2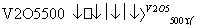 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+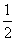 O2(g)===H2O(l)
O2(g)===H2O(l)
ΔH=-285.8 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
对于化学反应3W(g)+2X(g)  4Y(g)+3Z(g),下列反应速率关系中错误的是
4Y(g)+3Z(g),下列反应速率关系中错误的是
A.2υ(W)=3υ(X) B.2υ(X)=3υ(Z) C.2υ(Y)=4υ(X) D.3υ(Y)=4υ(Z)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com