
| A. | 恒温下向溶液中加CaO,溶液的pH升高 | |
| B. | 给溶液加热,溶液的pH升高 | |
| C. | 恒温下向溶液中加入CaO后,溶液中的c(OH-)不变 | |
| D. | 向溶液中加入少量的NaOH固体,Ca(OH)2固体的质量不变 |
分析 A.恒温下,加入CaO,CaO和水反应生成Ca(OH)2,溶液为过饱和溶液,有氢氧化钙析出,氢氧化钙溶解度不变;
B.升高温度,Ca(OH)2的溶解度降低;
C.恒温下,加入CaO,CaO和水反应生成Ca(OH)2,溶液为过饱和溶液,有氢氧化钙析出,氢氧化钙溶解度不变;
D.加入NaOH,溶液中氢氧根离子浓度增大,抑制Ca(OH)2溶解.
解答 解:A.恒温下,加入CaO,CaO和水反应生成Ca(OH)2,溶液为过饱和溶液,有氢氧化钙析出,氢氧化钙溶解度不变,所以c(OH-)不变,溶液的pH不变,故A错误;
B.升高温度,Ca(OH)2的溶解度降低,则溶液中c(OH-)减小,溶液的pH降低,故B错误;
C.根据A知,恒温下,加入CaO,CaO和水反应生成Ca(OH)2,溶液为过饱和溶液,有氢氧化钙析出,氢氧化钙溶解度不变,所以c(OH-)不变,溶液的pH不变,故C正确;
D.加入NaOH,溶液中氢氧根离子浓度增大,抑制Ca(OH)2溶解,所以Ca(OH)2固体的质量增大,故D错误;
故选C.
点评 本题考查难溶物的溶解平衡,侧重考查学生分析判断能力,明确饱和溶液特点及溶解平衡影响因素是解本题关键,易错选项是AB,注意:如果A不是恒温条件,CaO反应放出的热量导致溶液温度升高,氢氧化钙溶解度降低.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | B物质的相对分子质量 | D. | 气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入物质 | HCl(aq) | FeCl3 | NaOH | HCOONa | C2H5OH |
| 溶液的pH | 3 | 4 | 10 | 11 | 未确定 |
| 水的电离程度 | α1 | α2 | α3 | α4 | α5 |
| A. | α3>α1>α5>α2>α4 | B. | α4>α2>α5>α1>α3 | C. | α4>α2>α5>α3>α1 | D. | α1>α3>α5>α2>α4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
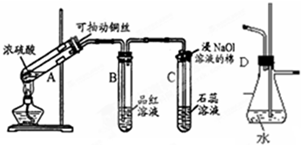 根据如图所示实验回答下列问题:
根据如图所示实验回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:HI>HBr>HCl>HF | |
| B. | 晶体熔点:金刚石>SiC>NaCl>Na>Mg>Al | |
| C. | 酸性:HClO4>H2SO4>H2SO3>HClO | |
| D. | 晶格能:MgF2>NaCl>NaBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
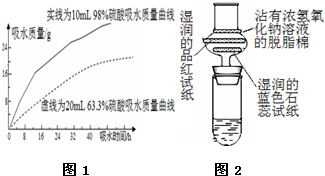 浓硫酸在高中化学实验中有着很重要的作用
浓硫酸在高中化学实验中有着很重要的作用查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理: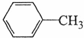 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$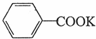 +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O +HCl→
+HCl→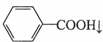 +KCl
+KCl| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 不溶 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 不溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4(100℃升华) | 25℃0.35g 80℃,2.7g | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CH2CHBrCH3与氢氧化钠的乙醇溶液反应 | |
| B. | 甲苯在催化剂作用下与Cl2发生苯环上的取代反应 | |
| C. | 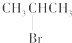 与NaOH的醇溶液共热反应 与NaOH的醇溶液共热反应 | |
| D. | 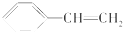 在催化剂存在下与H2完全加成 在催化剂存在下与H2完全加成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com