
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。

当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为4NaHSO3=2Na2S2O5+2H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为_____________。
(2)装置Y的作用是___________。
(3)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4,其可能的原因是_____。
(4)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

![]()
(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
【答案】 2SO2 + CO2-3 + H2O = 2HSO3- + CO2 安全瓶,防止倒吸 在制备过程中Na2S2O5分解生成Na2SO3,Na2S2O5被氧化生成Na2SO4 0.16 偏低
【解析】(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为2SO2 +CO32- +H2O=2HSO3- +CO2;(2)由于SO2或CO2与氢氧化钠溶液反应时容易倒吸,所以装置Y的作用是安全瓶,防止倒吸;(3)由于在制备过程中Na2S2O5分解生成Na2SO3,Na2S2O5被氧化生成Na2SO4,所以实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4。(4)①由题设滴定反应的化学方程式知,样品中抗氧化剂的残留量(以SO2计算)与I2的物质的量之比为1∶1,n(SO2)=n(I2)=0.01000mol·L-1×0.025L=0.0025mol,残留量=![]() =0.16g·L-1;②由于实验过程中有部分HI被氧化生成I2,4HI+O2=2I2+2H2O,导致与SO2反应的I2减少,因此实验结果偏低。
=0.16g·L-1;②由于实验过程中有部分HI被氧化生成I2,4HI+O2=2I2+2H2O,导致与SO2反应的I2减少,因此实验结果偏低。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】可逆反应mA(s)+nB(g)![]() eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( )
eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( )

A. 达到平衡后,若使用催化剂,C的体积分数将增大
B. 当平衡后,若温度升高,化学平衡向逆反应方向移动
C. 化学方程式中,n>e+f
D. 达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“HI(s)→HI(g)→H2和I2”的变化过程中,被破坏的作用力依次是( )
A. 范德华力、范德华力 B. 范德华力、共价键
C. 共价键、离子键 D. 共价键、共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物大分子通常都有一定的分子结构规律,即是由一定的基本结构单位,按一定的排列顺序和连接方式形成的多聚体,下列表述正确的是 ( )

A.若该图为一段肽链的结构模式图,则1表示肽键,2表示中心碳原子,3的种类有20种
B.若该图为一段RNA的结构模式图,则1表示核糖,2表示磷酸基团,3的种类有4种
C.若该图为一段单链DNA的结构模式图,则1表示磷酸基团,2表示脱氧核糖,3的种类有4种
D.若该图表示多糖的结构模式图,则淀粉、纤维素和糖原是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 氯气通入水中,有化学键的断裂与形成
B. MgCl2晶体中存在离子键与共价键
C. NH3和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D. CO2和SiO2晶体都是由分子构成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中中心原子的杂化方式和分子的空间构型均正确的是( )
A. C2H2:sp2、直线形
B. SO42-:sp3、三角锥形
C. H3O+:sp3、V形
D. BF3:sp2、平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
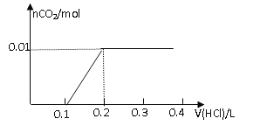
【题目】将0.8g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
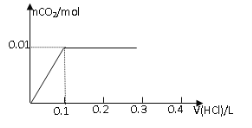
A B
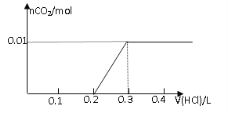
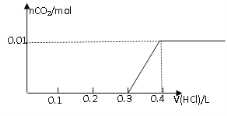
C D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关NaClO和NaCl混合溶液的叙述正确的是( )
A. 该溶液中,H+、NH![]() 、SO
、SO![]() 、Br-可以大量共存
、Br-可以大量共存
B. 该溶液中,Ag+、K+、NO![]() 、CH3CHO可以大量共存
、CH3CHO可以大量共存
C. 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+===Cl-+2Fe3++H2O
D. 向该溶液中加入浓盐酸,每产生1 mol Cl2,转移电子约为6.02×1023个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com