
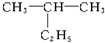
 命名为“2-乙基丙烷”,错误原因是主链选错;将其命名“3-甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.
命名为“2-乙基丙烷”,错误原因是主链选错;将其命名“3-甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.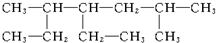 的名称为2,5-二甲基-4-乙基庚烷.
的名称为2,5-二甲基-4-乙基庚烷. 分析 (1) ,最长碳链含有4个C;编号从距离支链最近的一端命名为1号碳,2号C有1个甲基,该有机物命名为:2-甲基丁烷,据此解答即可;
,最长碳链含有4个C;编号从距离支链最近的一端命名为1号碳,2号C有1个甲基,该有机物命名为:2-甲基丁烷,据此解答即可;
(2)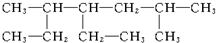 最长碳链为7,在2号碳和5号碳上分别含有1个甲基,据此解答即可.
最长碳链为7,在2号碳和5号碳上分别含有1个甲基,据此解答即可.
解答 解:(1) ,最长碳链含有4个C;编号从距离支链最近的一端命名为1号碳,2号C有1个甲基,该有机物命名为:2-甲基丁烷,命名为“2-乙基丙烷”,2号碳上出现乙基,说明主链选错,命名“3-甲基丁烷”,说明编号错误,故正确命名为:2-甲基丁烷;故答案为:主链选错;编号错误;2-甲基丁烷;
,最长碳链含有4个C;编号从距离支链最近的一端命名为1号碳,2号C有1个甲基,该有机物命名为:2-甲基丁烷,命名为“2-乙基丙烷”,2号碳上出现乙基,说明主链选错,命名“3-甲基丁烷”,说明编号错误,故正确命名为:2-甲基丁烷;故答案为:主链选错;编号错误;2-甲基丁烷;
(2)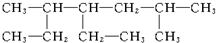 最长碳链为7,在2号碳和5号碳上分别含有1个甲基,正确命名为:2,5-二甲基-4-乙基庚烷,故答案为:2,5-二甲基-4-乙基庚烷.
最长碳链为7,在2号碳和5号碳上分别含有1个甲基,正确命名为:2,5-二甲基-4-乙基庚烷,故答案为:2,5-二甲基-4-乙基庚烷.
点评 本题考查了考查有机物的命名,题目难度不大,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练.


科目:高中化学 来源: 题型:选择题
| 弱酸 | H2CO3 | 水杨酸(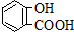 ) ) |
| 电离平衡常数(925℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-11 |
| A. | 常温下,等浓度、等体积的NaHCO3溶液pH小于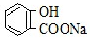 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2CO3溶液和  溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. |  +2NaHCO3→ +2NaHCO3→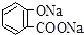 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1的原因之一是能形成分子内氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X单质分子中σ键和π键数目之比为1:2 |
| Y | Y 基态原子的最外层电子排布式为 nsnnpn+2 |
| Z | Z的第一电离能在同周期主族元素中最小 |
| W | W的氧化物是导致酸雨的主要物质之一 |
| R | 基态原子的核外电子排布中未成对的电子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3+H3PO4═NH4H2PO4 | B. | 2NH3+2Na═2NaNH2+H2 | ||
| C. | 8NH3+3Cl2═6NH4Cl+N2 | D. | 4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
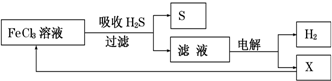
| A. | 吸收H2S的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+ | |
| B. | 电解时选用阴离子交换膜,电解过程中的阳极区反应主要为:2Cl--2e-=Cl2 | |
| C. | 电解过程中若阴极产生2.24L气体,则阳极区产生0.2mol Fe3+ | |
| D. | 实验室可用点燃充分燃烧的方法消除H2S污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com