
| A. | 16g O2和O3的混合气体中含有的分子数为0.5NA | |
| B. | 25℃时,KSP(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA | |
| C. | 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA | |
| D. | 常温下,1mol的NaHCO3固体中含HCO3-的数目为NA |
分析 A、氧气和臭氧的摩尔质量不同;
B、溶液体积不明确;
C、氯气和水的反应为可你反应;
D、NaHCO3固体由钠离子和碳酸氢根构成.
解答 解:A、氧气和臭氧的摩尔质量不同,且两者比例不明确,故16g混合物的物质的量无法计算,则分子个数无法计算,故A错误;
B、溶液体积不明确,故溶液中的钡离子的个数无法计算,故B错误;
C、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于0.1NA个,故C错误;
D、NaHCO3固体由钠离子和碳酸氢根构成,故1mol碳酸氢钠固体中含NA个碳酸氢根,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 取少量待检验溶液,向其中加入少量新制氯水,在滴加KSCN溶液,溶液呈血红色 | 待测液中含有Fe3+ |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(Ba2SO4)<Ksp(Ca2SO4) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
| D | 室温下,用PH试纸测得:0.1mol•L-1 Na2SO3溶液的PH约为10;0.1mol•L-1 NaHSO3溶液的PH约为5 | HSO3-结合H+的能力比SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
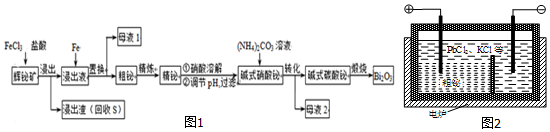
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,23gNO2和N2O4混合气体中含O原子数为NA | |
| B. | 1mol/L Al2(SO4)3溶液中含SO42-个数为3NA,含Al3+个数小于2NA | |
| C. | 在标准状况下,将22.4L SO3溶于水配成1L溶液,所得溶液中含SO42-个数为NA | |
| D. | 将1moL 氯气通入到足量水中,则N(HClO)+N(Cl-)+N(ClO-)═2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑火药由硝石、硫磺、木炭按一定比例混合制成,其中“硝石”指的是硝酸钾 | |
| B. | “青篙一握,以水二升渍,绞取汁”,该挺取青蒿素的过程属于化学变化 | |
| C. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合反应 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.00mol NaCl中含有NA个NaCl 分子 | |
| B. | 常温常压下,22.4LCl2与足量镁粉反应,转移的电子数为2NA | |
| C. | 一定条件下,2.3gNa与足量O2完全反应生成3.6g产物时失去的电子数为0.1NA | |
| D. | 28g乙烯和环丙烷(C3H6)组成的混合气体中含有氢原子的个数为3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com